题目内容
3.牙齿洁白,人人喜欢.将漂白剂沾在牙套上,牙齿咬住牙套可使牙齿变得洁白.下列物质溶于水后所得溶液可作为牙齿漂白剂的是( )| A. | Cl2 | B. | HNO3 | C. | Na2O2 | D. | H2O2 |
分析 牙齿漂白剂应无毒,在口腔内反应后的产物无毒,无腐蚀性;
解答 解:虽然都具有漂白性,但C12的水溶液有毒,HNO3具有腐蚀性,Na2O2能与水剧烈反应且生成的氢氧化钠具有腐蚀性,双氧水还原产物是水,适合漂白牙齿.
故选D.
点评 本题考查常见的漂白剂,难度不大,注意C12、HNO3、Na2O2、双氧水漂白性的区别.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
13.按要求完成下列各题
(1)精炼铜时,阴极材料是纯铜,阴极的电极反应式是Cu2++2e-=Cu,
(2)氯碱工业电解饱和食盐水的总反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是Mn2++2H2O-2e-=MnO2+4H+
(4)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-离子.电池工作时正极反应式为O2+4e-=2O2-.
若以该电池为电源,用石墨做电极电解100mL含有如下离子的液.
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为0.1mol.
(1)精炼铜时,阴极材料是纯铜,阴极的电极反应式是Cu2++2e-=Cu,
(2)氯碱工业电解饱和食盐水的总反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是Mn2++2H2O-2e-=MnO2+4H+
(4)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-离子.电池工作时正极反应式为O2+4e-=2O2-.
若以该电池为电源,用石墨做电极电解100mL含有如下离子的液.
| 离子 | Cu2+ | H+ | Cl- | SO$\stackrel{2-}{4}$ |
| c/(mol•L-1) | 1 | 4 | 4 | 1 |
14.N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0;一定温度下,向10L恒容密闭容器中通入N2O5,的部分实验数据见下表:下列说法不正确的是( )
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol | 5.00 | 3.5 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为3×10-4mol•(L•s)-1 | |
| B. | 反应达平衡后,往容器中加入5molN2O5气体,平衡正向移动,反应的热效应变大 | |
| C. | 相同温度下,起始时向容器中充入5molNO2和1.25molO2,达到平衡时,NO2的转化率小于50% | |
| D. | 达到平衡后,相同条件下往容器中充入2.5molN2O5和1.25molO2,此时平衡将向右移动 |
11.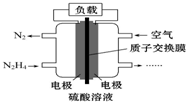 液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )
液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )
 液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )
液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | 负极发生的电极反应式为N2H4-4e-═N2↑+4H+ | |
| C. | 利用该燃料电池工业上可以电解MgCl2溶液制备Mg | |
| D. | 该燃料电池持续放电时,右侧电池区中因电极反应消耗H+,故c(H+)逐渐减小 |
18.短周期元素W、X、Y、Z的原子序数依次增大,W的单质是空气中体积分数最大的气体,W与Y原子的最外层电子数之和为X原子的最外层电子数的2倍,Z原子的最外层电子数等于其最内层电子数,X、Y、Z的简单离子的电子层结构相同.下列说法正确的是( )
| A. | 气态氢化物的稳定性:Y>X>W | |
| B. | 四种元素的原子中W原子半径最大 | |
| C. | 四种元素中最高价氧化物的水化物酸性Y最强 | |
| D. | 化合物XY2与ZY2分子中的化学键类型相同 |
8.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),其中曲线走势与元素有关性质相符的是( )
| A. | 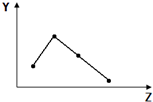 如图表示ⅥA族元素的氢化物的沸点 | |
| B. | 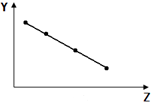 如图表示ⅦA族元素的熔点 | |
| C. | 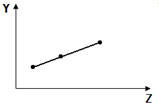 如图表示Na+、Mg2+、Al3+的半径 | |
| D. |  如图表示第三周期元素的单质的熔点 |
15.室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是( )
| A. | NH${\;}_{4}^{+}$、Cu2+、Cl-、NO${\;}_{4}^{2-}$ | B. | K+、Na+、CO${\;}_{3}^{2-}$、S2- | ||
| C. | K+、Na+、CH3COO-、SO${\;}_{4}^{2-}$ | D. | Ba2+、Mg2+、HCO${\;}_{3}^{-}$、Cl- |
12.下列条件下,两瓶气体所含原子数一定相等的是( )
| A. | 同质量、不同密度的N2和CO2 | B. | 同温度、同体积的H2和N2 | ||
| C. | 同体积、同密度的O2和O3 | D. | 同压强、同体积的NO2和CO2 |
13.制取水煤气的反应为C(s)+H2O(g)═CO(g)+H2(g)△H>0,欲提高反应的速率和C(s)的转化率,可采用的措施为( )
| A. | 降温 | B. | 增大水蒸气的浓度 | ||
| C. | 增大C(s)的量 | D. | 增大压强 |