题目内容
1.下列各组物质,其分子数相同的是( )| A. | 1gH2和8g O2 | |
| B. | 1molCO和22.4L水蒸气(一个标准大气压、100℃) | |
| C. | 18g水和标况时22.4L CO2 | |
| D. | 3molSO2和2mol SO3 |
分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$计算,注意物质存在的条件以及状态.
解答 解:A.n(H2)=$\frac{1g}{2g/mol}$=0.5mol,n(O2)=$\frac{8g}{32g/mol}$=0.25mol,二者物质的量不相等,含有的分子数目不相等,故A错误;
B.一个标准大气压、100℃下,气体的Vm≠22.4L/mol,故B错误;
C.水的物质的量为$\frac{18g}{18g/mol}$=1mol,二氧化碳的体积为$\frac{22.4L}{22.4L/mol}$=1mol,二者物质的量不相等,含有的分子数目不相等,故C正确;
D.3molSO2和2mol SO3的物质的量不同,则分子数不同,故D错误.
故选C.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关公式的运用以及物质的构成特点,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.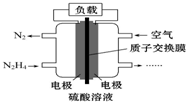 液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )
液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )
 液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )
液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | 负极发生的电极反应式为N2H4-4e-═N2↑+4H+ | |
| C. | 利用该燃料电池工业上可以电解MgCl2溶液制备Mg | |
| D. | 该燃料电池持续放电时,右侧电池区中因电极反应消耗H+,故c(H+)逐渐减小 |
12.下列条件下,两瓶气体所含原子数一定相等的是( )
| A. | 同质量、不同密度的N2和CO2 | B. | 同温度、同体积的H2和N2 | ||
| C. | 同体积、同密度的O2和O3 | D. | 同压强、同体积的NO2和CO2 |
13.制取水煤气的反应为C(s)+H2O(g)═CO(g)+H2(g)△H>0,欲提高反应的速率和C(s)的转化率,可采用的措施为( )
| A. | 降温 | B. | 增大水蒸气的浓度 | ||
| C. | 增大C(s)的量 | D. | 增大压强 |
10.用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | NA个N2分子与NA个CO分子的质量比为1:1 | |
| B. | 水的摩尔质量等于NA个水分子的相对质量之和 | |
| C. | 在常温常压下11.2LN2含有的分子数为0.5NA | |
| D. | 1mol•L-1NaCl溶液中、含有NA个Na+ |
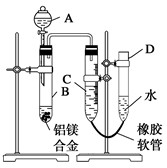 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.