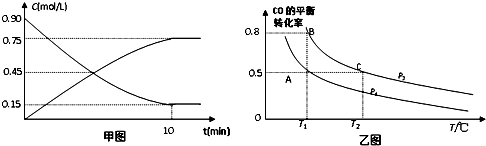
题目内容
20.下列除去杂质(括号内的是杂质)所选用的试剂合理的是( )| A. | Al (Fe):浓硝酸 | B. | MgO(Al2O3):盐酸 | ||
| C. | FeCl3(FeCl2):氯水 | D. | FeCl2(CuCl2):氢氧化氢钠溶液 |
分析 A.二者都与浓硝酸反应;
B.二者都与盐酸反应;
C.氯化亚铁与氯气反应生成氯化铁;
D.二者都与氢氧化钠溶液反应.
解答 解:A.浓硝酸与铁、铝常温下都发生钝化反应,不能除杂,应用磁铁除杂,故A错误;
B.氧化铝为两性氧化物,应用氢氧化钠溶液除杂,故B错误;
C.氯化亚铁与氯气反应生成氯化铁,可用于除杂,故C正确;
D.铁可与氯化铜发生置换反应生成铜,可处在氯化铜,如用氢氧化钠溶液,与二者都发生反应,不能除去杂质,故D错误.
故选C.
点评 本题考查物质的分离提纯,侧重于学生综合运用化学知识的能力和实验能力的考查,为高考常见题型,题目难度不大,注意把握物质的性质的异同.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
10.在气体反应中,能使反应物中活化分子数和活化分子百分数同时增加的方法是( )
| A. | 增大反应物浓度 | B. | 升高温度 | C. | 增大压强 | D. | 加入正催化剂 |
11.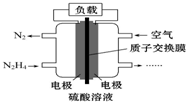 液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )
液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )
 液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )
液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | 负极发生的电极反应式为N2H4-4e-═N2↑+4H+ | |
| C. | 利用该燃料电池工业上可以电解MgCl2溶液制备Mg | |
| D. | 该燃料电池持续放电时,右侧电池区中因电极反应消耗H+,故c(H+)逐渐减小 |
8.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),其中曲线走势与元素有关性质相符的是( )
| A. | 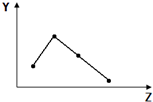 如图表示ⅥA族元素的氢化物的沸点 | |
| B. | 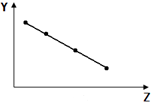 如图表示ⅦA族元素的熔点 | |
| C. | 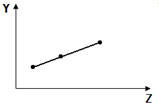 如图表示Na+、Mg2+、Al3+的半径 | |
| D. |  如图表示第三周期元素的单质的熔点 |
15.室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是( )
| A. | NH${\;}_{4}^{+}$、Cu2+、Cl-、NO${\;}_{4}^{2-}$ | B. | K+、Na+、CO${\;}_{3}^{2-}$、S2- | ||
| C. | K+、Na+、CH3COO-、SO${\;}_{4}^{2-}$ | D. | Ba2+、Mg2+、HCO${\;}_{3}^{-}$、Cl- |
5.实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol (CH2)6N4H+与 l mol H+相当,然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g.
步骤II 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤III 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤III 填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察B
(A)滴定管内液面的变化 (B)锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成粉红(或浅红)色.
(2)滴定结果如表所示:
若NaOH标准溶液的浓度为0.1010mol•L-1,则该样品中氮的质量分数为18.85%.
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol (CH2)6N4H+与 l mol H+相当,然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g.
步骤II 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤III 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤III 填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察B
(A)滴定管内液面的变化 (B)锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成粉红(或浅红)色.
(2)滴定结果如表所示:
| 滴定 次数 | 待测溶液的体积 /mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
12.下列条件下,两瓶气体所含原子数一定相等的是( )
| A. | 同质量、不同密度的N2和CO2 | B. | 同温度、同体积的H2和N2 | ||
| C. | 同体积、同密度的O2和O3 | D. | 同压强、同体积的NO2和CO2 |
10.用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | NA个N2分子与NA个CO分子的质量比为1:1 | |
| B. | 水的摩尔质量等于NA个水分子的相对质量之和 | |
| C. | 在常温常压下11.2LN2含有的分子数为0.5NA | |
| D. | 1mol•L-1NaCl溶液中、含有NA个Na+ |