题目内容
15.为探究 Na、Mg、Al的金属性强弱顺序,某课外小组同学进行了如下实验:| 实验步骤 | 1.将一小块金属钠放入滴有酚酞溶液的冷水中 2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液 3.将一小段镁带投入稀盐酸中 4.将一小片铝投入稀盐酸中 |
| 实验现象 | ①剧烈反应,迅速生成大量的气体 ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 ③反应不剧烈,产生无色气体 ④有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 |
(3)该实验得出的结论是Na、Mg、Al的金属活动性顺序由强到弱.
(4)用原子结构理论解释上述实验结论:同周期元素从左至右原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小(填“增大”或“减小”),原子核对核外电子的引力逐渐增强,失电子能力逐渐减弱(填“增强”或“减弱”),因此金属性逐渐减弱(填“增强”或“减弱”).
分析 (1)越是活泼的金属,和酸或者水反应越剧烈,置换出氢气越容易,生成碱的碱性越强,依据反应现象分析;
(2)钠与水剧烈反应生成氢氧化钠和氢气;
(3)根据以上反应现象判断金属钠、镁、铝的活动性顺序,与水反应越剧烈,说明金属活泼性越强;
(4)从原子半径和失电子能力角度来解释金属性强弱关系,同周期元素从左至右原子的电子层数相同,核电荷数逐渐增多,原子半径减小,金属性减弱.
解答 解:(1)金属钠、镁、铝位于同一周期,按照从左到右的顺序失电子能力逐渐减小,和水及酸反应置换出氢气的程度是越来越难,所以:1对应的现象为②、2对应的现象为④、3对应的现象为①、4对应的现象为③,
故答案为:
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | ② | ④ | ① | ③ |
(3)根据金属和酸以及水的反应的剧烈程度,与水反应越剧烈,说明金属活泼性越强,可以知道:金属活动性顺序为:Na>Mg>Al,
故答案为:Na、Mg、Al的金属活动性顺序由强到弱;
(4)同周期元素从左到右核电荷数逐渐增多,原子半径逐渐减小,原子核对核外电子的吸引力逐渐增强,失电子能力逐渐减弱,金属性逐渐减弱,
故答案为:减小;减弱;减弱.
点评 本题考查学生同一周期元素性质的递变规律知识,结合试验的方式考查,增加了题目的处理难度,题目难度中等.

练习册系列答案
相关题目
5.下列分子中,键的极性最强的是( )
| A. | PH3 | B. | H2S | C. | HBr | D. | HCl |
3.下列说法中,错误的是( )
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| C. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| D. | 化学反应中能量变化的大小与反应物的质量多少无关 |
10.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
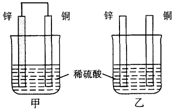

| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中硫酸溶液的浓度均下降 | D. | 产生气泡的速度甲比乙慢 |
20.关于CO2说法正确的是( )
| A. | 碳原子采取sp1杂化 | B. | CO2是正四面体型结构 | ||
| C. | 干冰是原子晶体 | D. | CO2为极性分子 |
7.使用氢氧燃料电池的汽车已在北京街头出现.下列有关该氢氧燃料电池的说法中,正确的是( )
| A. | H2在正极发生氧化反应 | |
| B. | 供电时的总反应是 2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$ 2H2O | |
| C. | 氢氧燃料电池中反应放出的热量转变为电能 | |
| D. | 产物是无污染的水,属于环境友好电池 |
5.在图所示的原电池中,下列说法正确的是( )
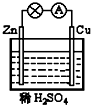

| A. | 正极反应为 Cu-2e-Cu2+ | B. | 溶液中H+向锌片移动 | ||
| C. | 电子由锌片通过导线流向铜 | D. | 该装置能将电能转化为化学能 |
 在一体积为10L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O浓度变化如图所示:
在一体积为10L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O浓度变化如图所示: