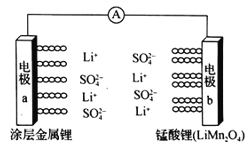
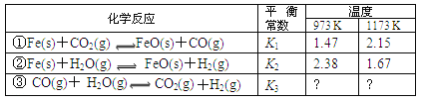
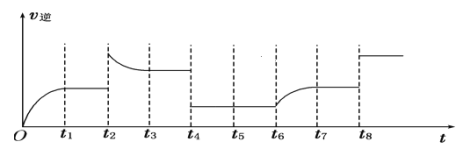
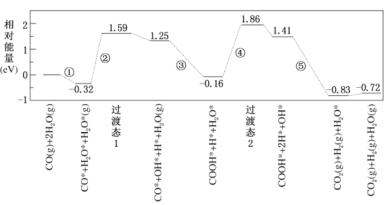
题目内容
【题目】新型冠状病毒来势汹汹,但是它依然可防可控。84消毒液具有强氧化性,可将冠状病毒外的包膜破坏后使RNA被降解,使病毒失活,以达到灭菌的效果。制取84消毒液的氯气可用加热浓盐酸和MnO2混合物来制取,也可用浓盐酸和KClO3直接混合来制取。回答下列问题:
(1)在周期表中与Mn相邻且未成对电子数最多的原子的价电子排布式为:___。
(2)K和O第一电离能I1(K)___I1(O)(填“大于”或“小于”)。原因是___。
(3)浓盐酸为HCl的水溶液,HCl极易溶于水的原因___,HCl和H2O中沸点较高的是___,其原因是___。
(4)KClO3晶体中,阴离子的空间构型为___,Cl的杂化轨道与O的2p轨道形成___键。
(5)金属K晶体为体心立方堆积,K原子半径为rpm,摩尔质量为Mg·mol-1,阿伏加德罗常数为NA,则晶体密度为___g﹒cm-3。(列出计算式)
【答案】3d54s1 K的原子半径比O大对核外电子的吸引力弱与O 小于 HCl为极性分子,且在水中极易电离出氢离子,氢离子与水形成稳定的水合离子 H2O 水分子之间存在氢键 三角锥形 σ 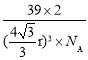 ×1030
×1030
【解析】
(1)与锰相邻的元素有Cr,Fe,Tc(锝,第五周期第ⅦB族),其中未成对电子数最多的为Cr,为24号元素,价电子排布为3d54s1;
(2)K的原子半径比O大对核外电子的吸引力弱与O,所以K的第一电离能小于O的第一电离能;
(3)HCl为极性分子,且在水中极易电离出氢离子,氢离子与水形成稳定的水合离子;水分子之间存在氢键,因此H2O的沸点高于HCl的沸点;
(4)KClO3晶体中阴离子为ClO3-,其中心原子价层电子对数为![]() ,含有一对孤电子对,所以空间构型为三角锥形;Cl原子采取sp3杂化,杂化轨道与O的2p轨道形成σ键;
,含有一对孤电子对,所以空间构型为三角锥形;Cl原子采取sp3杂化,杂化轨道与O的2p轨道形成σ键;
(5)金属K晶体为体心立方堆积,K原子半径为rpm,其体对角线上的3个K原子相切,设晶胞的棱长为a pm,则有![]() ,则其晶胞的棱长为a=
,则其晶胞的棱长为a=![]() pm,则晶胞的体积V=
pm,则晶胞的体积V=![]() pm3=
pm3=![]() ×10-30cm3;晶胞中K原子的数目为
×10-30cm3;晶胞中K原子的数目为![]() ,所以晶胞的质量m=
,所以晶胞的质量m=![]() ,所以晶体的密度为
,所以晶体的密度为 g﹒cm-3。
g﹒cm-3。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化