题目内容
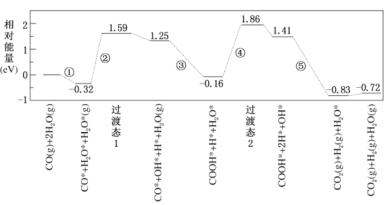
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。下列说法正确的是
A.水煤气变换反应的△H>0
B.步骤③的化学方程式:CO*+OH*+H2O(g)=COOH*+H2O*
C.步骤⑤只有非极性键HH键形成
D.该历程中最大能垒(活化能)E正=1.70eV
【答案】B
【解析】
分析图象可知,水煤气的生成过程经过了过渡态1和过渡态2,最后生成产物的能量低于反应物,故反应过程中放出能量,结合图象进行分析判断。
A.根据水煤气变换反应并结合反应历程相对能量可知,CO(g)+H2O(g)的能量高于CO2(g)+H2(g)的能量,反应的焓变ΔH小于0,A项错误;
B.结合此图分析判断,③是发生的过渡反应:CO*+OH*+H2O(g)=COOH*+H2O*,B项正确;
C.由图可知步骤⑤中H-O键,在原反应物中已经存在,则步骤⑤形成的化学键包括极性键C=O,非极性键H-H键形成,C项错误;
D.该历程中最大能垒(活化能)E正=1.86eV-(-0.16eV)=2.02eV,D项错误;
答案选B。

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
【题目】下列有关事实及原因的分析中,错误的是![]()
![]()
事实 | 原因 | |
A. | 分子内不同化学键之间存在键角 | 共价键具有方向性 |
B. |
|
|
C. | 不含金属元素的化合物均是共价化合物 | 非金属元素间不能形成离子键 |
D. |
|
|
A.AB.BC.CD.D