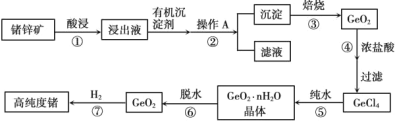
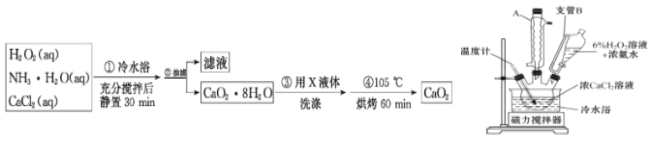
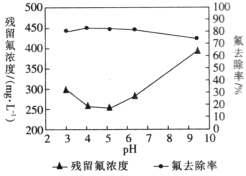
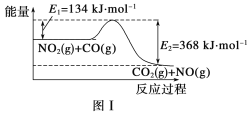
题目内容
【题目】下列关于碱金属元素的说法正确的是( )
①原子结构的相同点是最外层电子数相同,都为1
②原子结构的不同点是随核电荷数的增加,电子层数增多,原子半径增大
③具有相似的化学性质,都是活泼金属
④都具有强还原性,在化合物中显![]() 价
价
⑤化学性质有差别,从Li到Cs,失电子能力逐渐增强
A.①③④B.①③⑤C.②④⑤D.①②③④⑤
【答案】D
【解析】
①碱金属原子结构的相同点是最外层电子数都为1,故①正确;
②碱金属原子结构的不同点,例如半径逐渐增大,是随核电荷数的增加,电子层数增多,原子半径增大,故②正确;
③由最外层电子数相等,具有相似的化学性质,都是活泼金属,故③正确;
④最外层的1个电子都容易失去,具有强还原性,在化合物中显+1价,故④正确;
⑤从Li到Cs由于半径增大,原子核对最外层电子的吸引能力减弱,失电子能力逐渐增强,电子层数不同造成化学性质有差别,故⑤正确。
答案选D。

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
【题目】下列有关事实及原因的分析中,错误的是![]()
![]()
事实 | 原因 | |
A. | 分子内不同化学键之间存在键角 | 共价键具有方向性 |
B. |
|
|
C. | 不含金属元素的化合物均是共价化合物 | 非金属元素间不能形成离子键 |
D. |
|
|
A.AB.BC.CD.D