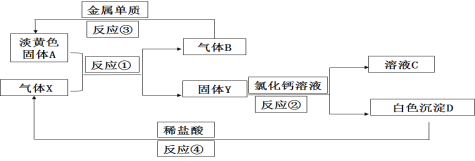
题目内容
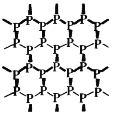
【题目】磷烯(如图)是由磷原子六元环组成的蜂巢状褶皱二维晶体,它是白磷(![]() )的同素异形体。设NA为阿伏加德罗常数,下列说法正确的是
)的同素异形体。设NA为阿伏加德罗常数,下列说法正确的是
A.3.1g白磷中含P—P键的数目为0.3NA
B.6.2g磷烯中含六元环的数目为0.1NA
C.0.1molP4与0.6molH2在密闭容器中发生反应P4+6H2![]() 4PH3,生成PH3分子的数目为0.4NA
4PH3,生成PH3分子的数目为0.4NA
D.0.1molP4发生反应P4+5O2=2P2O5,转移的电子数为20NA
【答案】B
【解析】
A. 3.1g白磷的物质的量为![]() ,一分子白磷中含有6根P—P键,则3.1g白磷中P—P键的数目为0.025×6NA=0.15NA,故A错误;
,一分子白磷中含有6根P—P键,则3.1g白磷中P—P键的数目为0.025×6NA=0.15NA,故A错误;
B. 6.2g磷烯的物质的量为0.2mol,根据均摊法知,一个六元环含有P原子的数目为![]() ,则6.2g磷烯含六元环的数目为0.1NA,故B正确;
,则6.2g磷烯含六元环的数目为0.1NA,故B正确;
C. 该反应为可逆反应,不能完全进行到底,因此生成PH3分子的数目应小于0.4NA,故C错误;
D. P元素的化合价从0升高为+5价,O元素的化合价从0降低为-2价,则1molP4失电子数目为20NA,在氧化还原反应中,氧化剂得电子数=还原剂失电子数=转移电子数,则0.1molP4发生反应转移的电子数为2NA,故D错误;
故选B。

练习册系列答案
相关题目