题目内容
【题目】50 mL 1.0molL﹣1盐酸跟50 mL 1.1 molL﹣1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是___________。
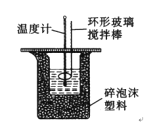
(2)大烧杯上如不盖硬纸板,对求得中和热数值的影响是_____(填“偏高”“偏低”或“无影响”)。
(3)如果改用60 mL 1.0 molL﹣1盐酸跟50 mL 1.1 molL﹣1氢氧化钠溶液进行反应,则与上述实验相比,所放热量_____(填“增加”“减少”或“不变”);所求中和热数值_____(填“增加”“减少”或“不变”)。
(4)_____(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液。
(5)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2﹣t1)/℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00 gcm﹣3,中和后混合液的比热容c=4.184×10﹣3kJg﹣1℃﹣1则该反应的中和热为△H=_____(保留小数点后一位)。
(6)上述实验数值结果与57.3 kJmol﹣1有偏差,产生偏差的原因可能是_____(填字母)。
a.实验装置保温、隔热效果差 b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
【答案】铜丝传热快,热量散失快 偏低 增加 不变 不能 ﹣56.5kJ/mol acd
【解析】
(1)金属是热的良导体,易传热;
(2)不盖硬纸板,会有一部分热量散失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,中和热是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,;
(4)氢氧化钡与硫酸反应生成了硫酸钡沉淀,生成沉淀的过程中会有热量变化;
(5)先判断三次反应温度差的有效性,然后求出平均值,根据公式Q=cm△t来求出生成0.05mol的水放出热量,最后根据中和热的概念求出中和热;
(6)根据(5)的计算结果与57.3 kJmol﹣1相比较,结合实验操作对实验的结果分析判断。
(1)铜丝搅拌棒是热的良导体,热量散失快,不能将环形玻璃搅拌棒改为铜丝搅拌棒,故答案为:铜丝传热快,热量散失快;
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会偏低,故答案为:偏低;
(3)反应放出的热量和所用酸以及碱的量的多少有关,若用60 mL 1.0 molL﹣1盐酸跟50 mL 1.1 molL﹣1氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,则放出的热量增加,由于中和热是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,因此所求中和热数值不变,故答案为:增加;不变;
(4)硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,生成硫酸钡沉淀过程中的生成热会影响反应的反应热,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,故答案为:不能;
(5)3次反应前后温度差分别为:7.6℃、6.7℃、6.8℃,第一组误差较大,应舍去,平均温度差为6.75℃,50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液的质量和m=100mL×1g/mL=100g,c=4.184J/(g℃),代入公式Q=cm△t得生成0.05mol的水放出热量Q=4.184J/(g℃)×100g×6.75℃=2.8242kJ,即生成0.05mol的水放出热量2.8242kJ,所以生成1mol的水放出热量为2.8242kJ×![]() =56.5kJ,即该实验测得的中和热△H=-56.5kJ/mol,故答案为:-56.5kJ/mol;
=56.5kJ,即该实验测得的中和热△H=-56.5kJ/mol,故答案为:-56.5kJ/mol;
(6)上述实验数值结果56.5kJ/mol比57.3 kJmol﹣1偏小。a.装置保温、隔热效果差,使得散失的热量偏多,测得的热量偏小,中和热的数值偏小,故a正确;b.量取盐酸溶液的体积时仰视读数,会导致所量的盐酸体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,使得散失的热量偏多,测得的热量偏小,中和热的数值偏小,故c正确;d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度,HCl溶液的起始温度偏高,测得的温差偏小,热量偏少,中和热的数值偏小,故d正确;故答案为:acd。

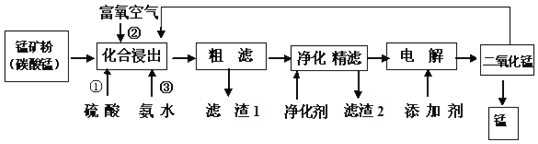
【题目】在钢铁工业中,锰的用量仅次于铁.锰的冶炼所用原料为锰矿石,主要含菱锰矿![]() ,另常含有
,另常含有![]() 、FeO、
、FeO、![]() 、NaCl和石灰等.
、NaCl和石灰等.
金属阳离子 |
|
|
|
|
|
开始至沉淀 完全的pH |
|
|
|
|
|
请回答下列问题:
![]() 在化合浸出中,为了提高浸出率提高产品纯度,通常采用______
在化合浸出中,为了提高浸出率提高产品纯度,通常采用______![]() 至少写两种方法
至少写两种方法![]()
![]() 在该工艺流程中滤渣1成分化学式为______;通常加入净化剂主要成分为
在该工艺流程中滤渣1成分化学式为______;通常加入净化剂主要成分为![]() ,滤渣2化学式为______.
,滤渣2化学式为______.
![]() 打捞韩国“岁月号”沉船是水下作业,潜水员需要呼吸的就是富氧空气.流程中用富氧空气作氧化剂,降低生产成本.流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是______
打捞韩国“岁月号”沉船是水下作业,潜水员需要呼吸的就是富氧空气.流程中用富氧空气作氧化剂,降低生产成本.流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是______
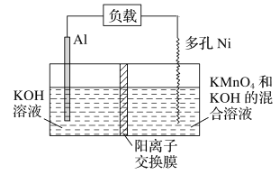
![]() 写出电解操作时阳极的电极反应式______.
写出电解操作时阳极的电极反应式______.
![]() 铝热法产生的废渣含有二氧化锰,可以作为氧化剂加入化合浸出,提高锰矿的利用率,则离子反应方程式是:______.
铝热法产生的废渣含有二氧化锰,可以作为氧化剂加入化合浸出,提高锰矿的利用率,则离子反应方程式是:______.
![]() 在电解液中
在电解液中![]() 不宜过大,否则在电解过程中会产生污染物,通常要定时检测
不宜过大,否则在电解过程中会产生污染物,通常要定时检测![]() 的大小,资料显示
的大小,资料显示![]() ,
,![]() ,且
,且![]() 为砖红色,通常采用
为砖红色,通常采用![]() 为滴定剂,用
为滴定剂,用![]() 作指示剂进行定量测定
作指示剂进行定量测定![]() 的大小.请描述该沉淀滴定终点时的现象:______;当
的大小.请描述该沉淀滴定终点时的现象:______;当![]() 沉淀完全时
沉淀完全时![]() 开始沉淀,此时溶液中
开始沉淀,此时溶液中![]() ______.
______.
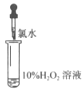
【题目】化学小组同学为探究氯水的成分及性质进行了如下实验:
实验① | 实验② | 实验③ | 实验④ | 实验⑤ | |
实验操作(氯水均为新制) |
|
|
|
|
|
实验现象 | 蒸馏水由无色逐渐变为浅黄绿色 | 溶液变蓝 | 石蕊溶液先变红,后褪色 | 产生白色沉淀 | 产生大量无色气泡 |
(试管中溶液均为1mL,均滴入氯水5滴)
(1)证明氯水中含有Cl-的是实验__(填序号),用离子方程式表示该实验中涉及的反应__。
(2)由实验②的现象可推断非金属性:Cl__I(填“>”或“<”),由原子结构解释其原因:Cl和I同主族,__,得电子能力:Cl>I(请补充完整)。
(3)实验③中溶液变红是由于溶液中含有__(填微粒符号,下同);使溶液褪色的微粒是__。
(4)同学们根据“H2O2在催化剂作用下可发生分解”的性质,认为实验⑤中现象不一定说明氧化性Cl2>H2O2。为证实Cl2将H2O2氧化,可继续补充实验:__(填操作、现象)。
(5)同学们发现久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如图曲线。
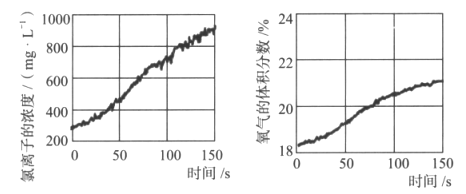
解释上两图中曲线变化的原因__。若在上述整个实验过程中测定溶液的pH,pH的变化是__。
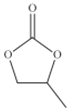
【题目】磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)红磷是巨型共价分子,无定型结构,下列方法能证明红磷是非晶体的是_____。
A.质谱法 B.原子发射光谱法 C.核磁共振谱法 D.X射线行射法
(2)基态As原子的核外电子排布式为_____,As原子的逐级电离能数据如下:
第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | 第五电离能 | 第六电离能 |
947.0 | 1798 | 2735 | 4837 | 6043 | 12310 |
为什么第五电离能与第六电离能相差较大_____。
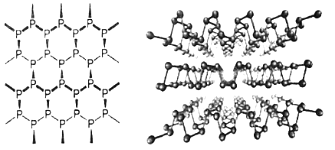
(3)黑磷是新型二维半导体材料,具有片层结构(如下图所示),P原子的杂化形式为_____,层与层之间的相互作用为_____。
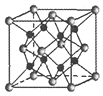
(4)GaAs的熔点为1238℃,且熔融状态不导电,其晶胞结构如下图所示,该晶体的类型为_____,每个As原子周围最近的As原子数目为_____,与同一个Ga原子距离最近的As原子构成的空间构型为_____,一个GaAs晶胞中配位键的数目为_____。
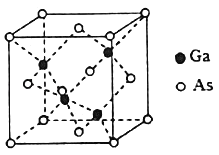
(5)已知GaAs的密度为dg/cm3,摩尔质量为Mg/mol,阿伏加德罗常数用NA表示,则晶胞中最近的As和Ga原子核间距为_____ nm(列式表示)。
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
化学键 | 键能kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
下列说法正确的是
A. 该反应为吸热反应B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1D. 生成1 mol NH3放出92 kJ热量