��Ŀ����
����Ŀ����ý�屨��������һ�ҹ�˾Tiamat��ǰ�з����ȵ�ǰ�㷺ʹ�õ�﮵�سɱ����͡���������������ٶȸ���������ӵ�أ�Ԥ�ƴ�2020�꿪ʼʵ�ֹ�ҵ�������õ�صĸ�������ΪNa2Co2TeO6���Ʊ�ԭ��ΪNa2CO3��Co3O4��TeO2�������ҺΪNaClO4��̼���ϩ����Һ���ش��������⣺
��1��Co ����Ԫ�����ڱ���______��Ԫ�أ����̬ԭ�ӵļ۵����Ų�ʽΪ______��
��2����̬Naԭ���У��������ռ�ݵ�ԭ�ӹ������Ϊ______������ܲ����������ͼ��״Ϊ_____
��3�����������Ϣ�жϣ�C��O��Cl�ĵ縺����С�����˳��Ϊ______����Ԫ�ط��ű�ʾ����
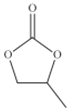
��4��ClO4 -�ļ��ι���Ϊ______��̼���ϩ���Ľṹ��ʽ��ͼ��ʾ��������̼ԭ�ӵ��ӻ��������Ϊ______��1mol̼���ϩ����![]() ������ĿΪ______��
������ĿΪ______��
��5��[Co��H2O��6]3+�ļ��ι���Ϊ���������Σ�������______���������Ӱ�����������Ϊ______����ѡ����ĸ����
A�����Ӽ�B��������C����λ��D�����E�����Լ�
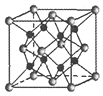
��6��Na��O�γɵ����ӻ�����ľ����ṹ��ͼ��ʾ��������O����λ��Ϊ______���þ������ܶ�Ϊ��g/cm3�������ӵ�������ֵΪNA����Na��O֮�����̾���Ϊ______nm���ú�����NA�Ĵ���ʽ��ʾ����
���𰸡�d 3d74s2 6 ���� C< Cl < O ���������� sp2��sp3 13NA ![]() C E 8
C E 8 ![]() ��
��![]() ��107nm
��107nm
��������
��1���������������ӵĹ������ȷ����������s����Ԫ��Ϊ��IA��IIA��Ԫ�أ���IB��IIB��Ϊds������ϵԪ�ء��ϵԪ��Ϊf������B����B�壨��ϵԪ�ء��ϵԪ�ز�����ڢ���Ϊd��Ԫ�أ���A����A�塢����Ϊp����
��2��ԭ�ӵĵ�����������ԭ�����������ݹ���ԭ����֪������Ų�ʽ���ݴ˿��жϸû�̬ԭ���е���ռ�ݵ�ԭ�ӹ��������s�ܼ�����������ͼ��״�����Σ�p�ܼ�����������ͼ��״�������Σ�
��3��Ԫ�صķǽ�����Խǿ��縺��Խ��
��4�����ݼ۲���ӶԻ�������ȷ�����ӿռ乹�ͼ�����ԭ���ӻ���ʽ���۲���ӶԸ���=��������+�µ��ӶԸ�������������=��ԭ�Ӹ������µ��ӶԸ���=![]() (a-xb)��aָ����ԭ�Ӽ۵��Ӹ�����xָ��ԭ�Ӹ�����bָ��ԭ���γ��ȶ��ṹ��Ҫ�ĵ��Ӹ���������̼ԭ�ӵijɼ����Ҫ���ж�̼ԭ�ӵ��ӻ���ʽ������Ϊsp3�ӻ���˫��Ϊsp2�ӻ�������Ϊsp�ӻ���
(a-xb)��aָ����ԭ�Ӽ۵��Ӹ�����xָ��ԭ�Ӹ�����bָ��ԭ���γ��ȶ��ṹ��Ҫ�ĵ��Ӹ���������̼ԭ�ӵijɼ����Ҫ���ж�̼ԭ�ӵ��ӻ���ʽ������Ϊsp3�ӻ���˫��Ϊsp2�ӻ�������Ϊsp�ӻ���
��5��[Co(H2O)6]3+�У�1��Coԭ�ӽ��6����λ�壬˵���ṩ6���չ��������λ���ӵ��γ��ǹ��ۼ���
��6������ͼ֪��O������λ����8�������ܶȹ�ʽ��=![]() ���㾧���о��������Na��O֮��ľ��롣
���㾧���о��������Na��O֮��ľ��롣
(1)���ݻ�̬ԭ�Ӻ�������Ų�ʽ����������������ȷ���������ƣ�Coԭ��Ϊ27��Ԫ�أ�λ�����ڱ��������ڡ���VIII�壬��Χ�����Ų�ʽΪ3d74s2������d����
(2)NaԪ�ص�ԭ������Ϊ11����̬ԭ�ӵĵ����Ų�ʽΪ��1s22s22p63s1��ÿ���ܼ���ĸǰ�����ֱ�ʾ���Ӳ���,���Ը�Ԫ�غ���3�����Ӳ�,���ݵ����ƵĿռ���״��֪�����ܼ�������ԭ�ӹ������s��p��d��f��˳������Ϊ1��3��5��7����Ԫ�غ���s��p�ܼ���6���������������Ϊ3s1���ӣ����ܲ���ӵĵ���������ͼ��״Ϊ���Σ�
(3)Ԫ�صķǽ�����Խǿ��縺��Խ��O��Cl��C�ķǽ����Դ�С˳����O>Cl>C��������縺�Դ�С˳����O>Cl>C��C< Cl<O��
(4) ClO4 -��Clԭ�Ӽ۲���ӶԸ���=4+![]() (7+14��2)=4���Ҳ����µ��Ӷԣ�����Clԭ�Ӳ���sp3�ӻ����ռ乹��Ϊ���������Σ�̼���ϩ����̼ԭ��Ϊ������˫���������γ�4��������û�й¶Ե��ӣ��ӻ������ĿΪ4��Ϊsp3�ӻ���˫���γ�3��������û�й¶Ե��ӣ��ӻ������ĿΪ3��sp2�ӻ�������̼ԭ�ӵ��ӻ��������Ϊsp2��sp3������������ĿΪ13���� l3NA(��13��6.02��1023)��
(7+14��2)=4���Ҳ����µ��Ӷԣ�����Clԭ�Ӳ���sp3�ӻ����ռ乹��Ϊ���������Σ�̼���ϩ����̼ԭ��Ϊ������˫���������γ�4��������û�й¶Ե��ӣ��ӻ������ĿΪ4��Ϊsp3�ӻ���˫���γ�3��������û�й¶Ե��ӣ��ӻ������ĿΪ3��sp2�ӻ�������̼ԭ�ӵ��ӻ��������Ϊsp2��sp3������������ĿΪ13���� l3NA(��13��6.02��1023)��
(5)�����������ԭ���ṩ�չ���������ṩ�µ��Ӷԡ�[Co(H2O)6]3+�ļ��ι���Ϊ���������Σ�Co3+�������ṩ�չ����������H2O�ṩ�µ��Ӷԣ�1��Co�ṩ6���չ���������д�����λ��������λ����HO��������Ϊ���Թ��ۼ���������ȷѡ��CE��
(6)��ɫ��ΪOԭ�ӣ������а�ɫ����ĿΪ8��![]() +6��
+6��![]() =4����ɫ��ΪNaԭ�ӣ���ԭ����λ����ԭ����Ŀ�ɷ��ȣ���Oԭ����λ��Ϊ4��2=8���������=
=4����ɫ��ΪNaԭ�ӣ���ԭ����λ����ԭ����Ŀ�ɷ��ȣ���Oԭ����λ��Ϊ4��2=8���������=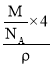 =
=![]() cm3�������߳�=
cm3�������߳�=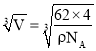 cm����Na��O֮�����̾���Ϊ
cm����Na��O֮�����̾���Ϊ![]() ��
��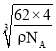 cm=
cm=![]() ��
��![]() ��107nm��
��107nm��

 �ο�������ϵ�д�
�ο�������ϵ�д� ������ѧ��ʱ��ҵϵ�д�
������ѧ��ʱ��ҵϵ�д� ���������ʱ��ѵϵ�д�
���������ʱ��ѵϵ�д� �㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
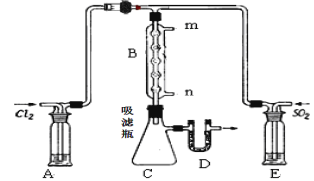
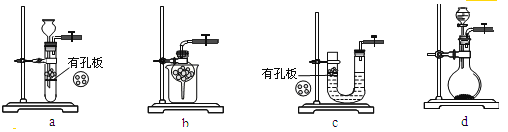
�㽭�¿γ���άĿ�������ʱ��ѵϵ�д�����Ŀ��50 mL 1.0molL��1�����50 mL 1.1 molL��1����������Һ��ͼ��ʾװ���н����кͷ�Ӧ����ͨ���ⶨ��Ӧ���������ų��������������к��ȡ��Իش��������⣺
��1��ʵ��ʱ������ͭ˿��������滷�β����������������___________��
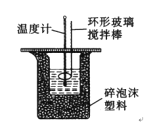
��2�����ձ����粻��Ӳֽ�壬������к�����ֵ��Ӱ����_____������ƫ������ƫ����������Ӱ��������
��3���������60 mL 1.0 molL��1�����50 mL 1.1 molL��1����������Һ���з�Ӧ����������ʵ����ȣ���������_____���������������������������������������к�����ֵ_____����������������������������������
��4��_____������������������������Ba��OH��2������������������������Һ��
��5��Q��cm��t������Q��ʾ���кͷ�Ӧ�ų���������m��ʾ��Ӧ����Һ��������c��ʾ��Ӧ������Һ�ı����ݣ���t��ʾ��Ӧǰ����Һ���¶ȵIJ�ֵ����ʵ��С����������ʵ�飬ÿ��ȡ��Һ��50 mL������¼����ԭʼ���ݣ�
ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �²t2��t1��/�� |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
��֪���ᡢNaOH��Һ�ܶȽ���Ϊ1.00 gcm��3���кͺ���Һ�ı�����c��4.184��10��3kJg��1����1��÷�Ӧ���к���Ϊ��H��_____������С�����һλ����
��6������ʵ����ֵ�����57.3 kJmol��1��ƫ�����ƫ���ԭ�������_____������ĸ����
a��ʵ��װ�ñ��¡�����Ч���� b����ȡ��������ʱ���Ӷ���
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨHCl��Һ���¶�