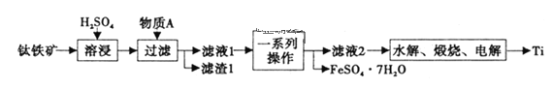
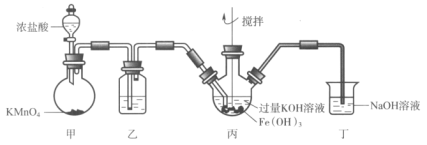
题目内容
【题目】在25 ℃时,有pH为a的HCl溶液和pH为b的NaOH溶液,取Va L该HCl溶液用该NaOH溶液中和,需Vb L NaOH溶液,问:
(1)若a+b=14,则Va∶Vb=___。
(2)若a+b=13,则Va∶Vb=___。
(3)若a+b>14,则Va∶Vb=___,且Va___Vb(填“>”“<”或“=”)。
(4).25 ℃时,将体积Va,pH=a的某一元强碱与体积为Vb,pH=b的某二元强酸混合。(书写步骤)
①若所得溶液的pH=11,且a=13,b=2,则Va∶Vb=________。
②若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b的值可否等于4________(填“可以”或“否”)
【答案】1 0.1 10a+b-14 > 1∶9 可以
【解析】
根据HCl与NaOH完全中和,溶液呈中性,则氢离子的物质的量=氢氧根的物质的量,据此解答。
根据强酸与强碱完全中和时,溶液呈中性,有n(H+)=n(OH-),即10-aVa=10b-14Vb,![]() =10a+b-14。
=10a+b-14。
(1)若a+b=14时, ![]() =100=1;答案为1。
=100=1;答案为1。
(2)若a+b=13时, ![]() =10-1=0.1;答案为0.1。
=10-1=0.1;答案为0.1。
(3)若a+b>14时, ![]() =10a+b-14,因为a+b>14,则
=10a+b-14,因为a+b>14,则![]() =10a+b-14>100=1,即Va>Vb;答案为10a+b-14,>。
=10a+b-14>100=1,即Va>Vb;答案为10a+b-14,>。
(4)①混合后溶液pH为11,说明碱过量,由a=13,b=2,则过量氢氧根浓度为10-3mol/L,强酸强碱中和后,OH-的浓度为:10-3=![]() , 99Va=11Vb,则
, 99Va=11Vb,则![]() =1∶9;答案为1:9。
=1∶9;答案为1:9。
②25℃时,将体积Va,pH=a的某一元强碱与体积为Vb,pH=b的某二元强酸混合,若b=4,酸溶液中c(H+)=10-4molL-1,b=0.5a,a=8,碱溶液中c(OH-)=10-6molL-1,则恰好中和,则有n(OH-)=n(H+),10-6×Va=10-4×Vb,![]() =
=![]() =102>1,符合Va>Vb,所以可以;答案为可以。
=102>1,符合Va>Vb,所以可以;答案为可以。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】50 mL 1.0molL﹣1盐酸跟50 mL 1.1 molL﹣1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是___________。
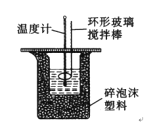
(2)大烧杯上如不盖硬纸板,对求得中和热数值的影响是_____(填“偏高”“偏低”或“无影响”)。
(3)如果改用60 mL 1.0 molL﹣1盐酸跟50 mL 1.1 molL﹣1氢氧化钠溶液进行反应,则与上述实验相比,所放热量_____(填“增加”“减少”或“不变”);所求中和热数值_____(填“增加”“减少”或“不变”)。
(4)_____(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液。
(5)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2﹣t1)/℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00 gcm﹣3,中和后混合液的比热容c=4.184×10﹣3kJg﹣1℃﹣1则该反应的中和热为△H=_____(保留小数点后一位)。
(6)上述实验数值结果与57.3 kJmol﹣1有偏差,产生偏差的原因可能是_____(填字母)。
a.实验装置保温、隔热效果差 b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )
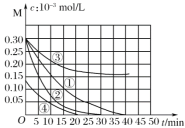
实验编号 | 温度℃ | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验④说明M的浓度越小,降解的速率越快