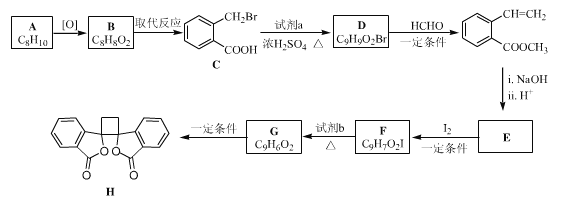
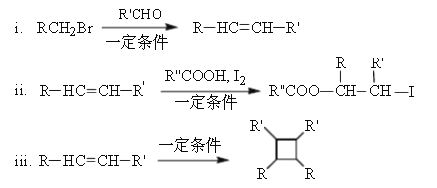
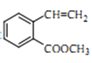
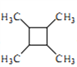
题目内容
【题目】化学反应原理对学习化学有重要的指导作用。某学习小组特邀你参与下列探究:
(1)影响化学平衡移动因素的探究:在NH4Cl 溶液中存在如下平衡:NH4Cl + H2O ![]() NH3.H2O + HCl,某同学以此为例探究外界条件对化学平衡的影响,实验结果记录如下:
NH3.H2O + HCl,某同学以此为例探究外界条件对化学平衡的影响,实验结果记录如下:
改变条件 | 适当升高温度 | 加水稀释 | 通入HCl(g) | 加少量NaOH固体 |
平衡移动方向 | 无需填写 | 正向 | 逆向 | 正向 |
①写出该反应的平衡常数表达式:____________________________。
②有同学认为,上表中在“条件改变”一栏除列举的4种之外,还添加一种就更为完美,你认为最好添加哪一种“改变条件”?_____________;
③“学习之道在于悟”,结合NH4Cl与水反应的方程式和影响平衡移动的因素分析:加水稀释对上述平衡的影响类似于_____________。
A.使用催化剂对化学平衡的影响; B.减小生成物浓度对化学平衡的影响;
C.升高温度对化学平衡的影响; D.减小压强对化学平衡的影响
(2)复分解反应进行的方向的探究
【提出问题】为什么只要有难溶物质、弱电解质、易挥发的物质生成复分解反应型离子反应就可以发生?
【分析解决问题】小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题。请你结合化学反应原理的相关知识对上述问题作出合理解释:生成难溶物质、弱电解质、易挥发的物质时将会导致体系的_______________或者__________________。
(3)反应条件(介质环境)的探究
已知I- 能被O2氧化生成I2,为探究反应条件(介质环境)设计了如下方案:
操作 | 现象 | |
第一组 | 向2mL1mol/LKI溶液中滴加几滴淀粉溶液 | 未出现蓝色 |
第二组 | 向2mL1mol/LKI溶液中滴加2mL1mol/LNaOH溶液再滴加几滴淀粉溶液 | 未出现蓝色 |
第三组 | 向2mL1mol/LKI溶液中滴加2mL1mol/LH2SO4溶液再滴加几滴淀粉溶液 | 溶液变蓝 |
①上述实验证明,该实验不能选择在中性或者碱性条件下进行,为什么?_____________;
②写出第三组实验中发生反应的离子方程式_____________;
【答案】 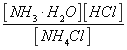 加少量NH4Cl固体(其他合理答案亦可) D 焓减(或H<0) 熵增(或S>0) O2在中性或者碱性条件下的还原产物为OH-,能与I2反应 O2 + 4I- + 4H+ = 2I2 + 2H2O
加少量NH4Cl固体(其他合理答案亦可) D 焓减(或H<0) 熵增(或S>0) O2在中性或者碱性条件下的还原产物为OH-,能与I2反应 O2 + 4I- + 4H+ = 2I2 + 2H2O
【解析】试题分析:(1)根据平衡常数的定义写平衡表达式;根据影响水解平衡移动的因素分析;③加水稀释,同等倍数的减小各微粒的浓度,类似与扩大容器体积减小压强。形成化学键放热;(3)①OH-能与I2反应;②第三组实验中I- 能被O2氧化生成I2。
解析:(1)水是纯液体,不能写入平衡常数表达式,所以该反应平衡常数=![]() ;根据影响水解平衡移动的因素,表格只有稀释溶液对平衡的影响,没有增大反应物浓度,所以“条件改变”一栏除列举的4种之外再加少量NH4Cl固体;③加水稀释,同等倍数的减小各微粒的浓度,类似与扩大容器体积减小压强,故选D。形成化学键放热,生成气体熵增大,生成难溶物质、弱电解质、易挥发的物质时将会导致体系的能量降低H<0或者熵增S>0;(3)①O2在中性或者碱性条件下的还原产物为OH-,OH-能与I2反应,造成淀粉溶液不变蓝;②第三组实验中I- 能被O2氧化生成I2,反应的离子方程式是O2 + 4I- + 4H+ = 2I2 + 2H2O。
;根据影响水解平衡移动的因素,表格只有稀释溶液对平衡的影响,没有增大反应物浓度,所以“条件改变”一栏除列举的4种之外再加少量NH4Cl固体;③加水稀释,同等倍数的减小各微粒的浓度,类似与扩大容器体积减小压强,故选D。形成化学键放热,生成气体熵增大,生成难溶物质、弱电解质、易挥发的物质时将会导致体系的能量降低H<0或者熵增S>0;(3)①O2在中性或者碱性条件下的还原产物为OH-,OH-能与I2反应,造成淀粉溶液不变蓝;②第三组实验中I- 能被O2氧化生成I2,反应的离子方程式是O2 + 4I- + 4H+ = 2I2 + 2H2O。