题目内容
6.指出下列化合物中化学键的类型、物质分类(离子化合物、共价化合物)以及溶于水时破坏的化学键的类型.| 化合物 | 化学键的类型 | 物质分类 | 溶于水时破坏的化学键的类型 |
| Na2S | |||
| HCl | |||
| (NH4)2SO4 |
分析 离子间通过离子键结合的化合物属于离子化合物,溶于水时破坏离子键;
原子间通过共价键结合的化合物属于共价化合物,溶于水时破坏共价键;据此分析.
解答 解:Na2S中钠离子与硫离子以离子键结合,属于离子化合物,溶于水时破坏离子键;
HCl中氢原子与氯原子之间通过共价键结合,属于共价化合物,溶于水破坏共价键;
(NH4)2SO4中存在N-H共价键和S-O共价键,铵根离子与硫酸根离子之间存在离子键,属于离子化合物,溶于水时破坏离子键;
故答案为:
| 化合物 | 化学键的类型 | 物质分类 | 溶于水时破坏的化学键的类型 |
| Na2S | 离子键 | 离子化合物 | 离子键 |
| HCl | 共价键 | 共价化合物 | 共价键 |
| (NH4)2SO4 | 共价键 离子键 | 离子化合物 | 离子键 |
点评 本题考查了化学键和化合物的判断,根据物质的构成微粒及微粒间的作用力来分析解答,题目难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
16.乙烯酮(CH2=C=O)在一定条件下能与含活泼氢的化合物发生加成反应,反应可表 .乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )
.乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )
 .乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )
.乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )| A. | 与CH3OH加成生成CH3CH2COOH | B. | 与H2O加成生成CH3COOH | ||
| C. | 与CH3COOH加成生成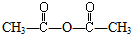 | D. | 与HCl加成生成CH3COCl |
14.下列叙述错误的是( )
| A. | 离子键没有方向性和饱和性,而共价键有方向性和饱和性 | |
| B. | 金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用 | |
| C. | 配位键在形成时,是由成键双方各提供一个电子形成共用电子 | |
| D. | 三种不同的非金属元素可以形成离子化合物 |
1.光导纤维常被用作制造石英表中的电压材料和高性能的现代通讯材料.下列物质中用于制造光导纤维的是( )
| A. | 玻璃钢 | B. | 陶瓷 | C. | 二氧化硅 | D. | 聚乙烯 |
11.下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题.
(1)金属性最强的元素是钙(填元素名称);
(2)a原子结构示意图为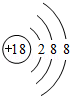 ;
;
(3)与a的电子层结构相同的3种简单离子的半径有小到大的顺序是Ca2+<Cl-<S2-(填离子符号);
(4)g是带来人类文明的重要元素之一,其氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(5)c、d的单质在加热条件下生成物质X,其中含有化学键的类型为离子键、共价键;该物质中阴离子与阳离子个数比1:2.
(6)写出一个由其中某种元素的最高价氧化物对应的水化物与其最低价氢化物反应生成的化合物的化学反应方程式:NH3+HNO3=NH4NO3.
| 主族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | O |
| 2 | b | h | c | |||||
| 3 | d | i | g | j | e | a | ||
| 4 | f |
(2)a原子结构示意图为
 ;
;(3)与a的电子层结构相同的3种简单离子的半径有小到大的顺序是Ca2+<Cl-<S2-(填离子符号);
(4)g是带来人类文明的重要元素之一,其氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(5)c、d的单质在加热条件下生成物质X,其中含有化学键的类型为离子键、共价键;该物质中阴离子与阳离子个数比1:2.
(6)写出一个由其中某种元素的最高价氧化物对应的水化物与其最低价氢化物反应生成的化合物的化学反应方程式:NH3+HNO3=NH4NO3.
16.关于1-氯丙烷和2-氯丙烷的比较,不正确的是( )
| A. | 它们是同分异构体 | |
| B. | 它们与NaOH的醇溶液共热后产物相同 | |
| C. | 它们均属多卤代烃 | |
| D. | 它们与NaOH的水溶液都能发生取代反应 |
 3-甲基-1-丁烯.
3-甲基-1-丁烯.

 ;
; ,该化合物所含化学键为共价键;
,该化合物所含化学键为共价键;