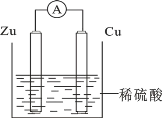
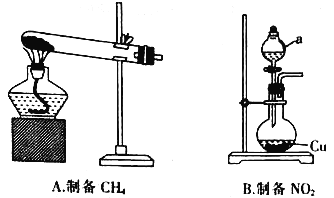
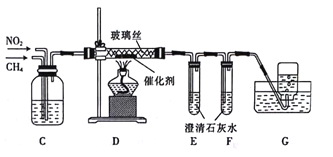
题目内容
【题目】三氧化二钴(Co2O3)常用于制滤光眼镜的添加剂、催化剂和氧化剂。以含钴废料(主要成分CoO、Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下:
(1)研磨的目的是____________。滤渣1的主要成分为______________(填化学式)。
(2)酸浸时双氧水的作用有___________。不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2,污染境,该反应的离子方程式为__________。
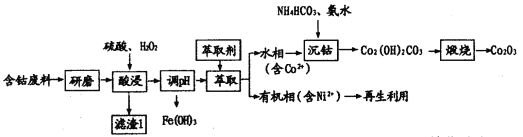
(3)在实验室里,萃取操作要用到的玻璃仪器主要有___________。有机相再生时提取出的Ni2+可用于制备氢镍电池,该电池充电时的总反应为Ni(OH)2+M![]() NiOOH+MH。则放电时正极的电极反应式为__________。
NiOOH+MH。则放电时正极的电极反应式为__________。
(4)沉钴时发生反应的离子方程式为_______。煅烧时发生反应的化学方程式为_______。
【答案】增大固体与液体的接触面积,使酸浸速率更快,酸浸更充分 MnO2 亚铁离子氧化为铁离子 Co2O3+6H++2Cl-= 2Co2++ Cl2↑+3H2O 分液漏斗、烧杯 NiOOH+e-+H+= Ni(OH)2 2 Co2++HCO3-+3NH3H2O= Co2(OH)2CO3+3NH4++H2O 2Co2(OH)2CO3+O2![]() 2Co2O3+2CO2+2H2O
2Co2O3+2CO2+2H2O
【解析】
含钴废料(主要成分CoO、Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3;先把原料进行酸浸,MnO2与稀硫酸不反应,成为滤渣;滤液中含有Co2+、Co3+、Ni2+、Fe2+、Fe3+等离子;调整溶液的pH,铁离子生成沉淀滤出;再把滤液进行萃取,含有Ni2+的物质进入有机相,水溶液中含有Co2+,然后加入碳酸氢铵和氨水,反应生成Co2(OH)2CO3,然后煅烧生成Co2O3,据以上分析进行解答。
(1)研磨的目的是增大固体与液体的接触面积,使酸浸速率更快,酸浸更充分;根据流程可知,铁离子变为氢氧化铁,镍离子进入有机相,水溶液中含有Co2+,经过一系列过程,最后得到氧化钴,所以滤渣1的主要成分为MnO2;综上所述,本题答案是:增大固体与液体的接触面积,使酸浸速率更快,酸浸更充分;MnO2。
(2)酸浸时,加入双氧水能够把亚铁离子氧化为铁离子;Co2O3与盐酸发生氧化还原反应生成Cl2,Co Cl2和水,该反应的离子方程式为:Co2O3+6H++2Cl-= 2Co2++ Cl2↑+3H2O;综上所述,本题答案是:亚铁离子氧化为铁离子;Co2O3+6H++2Cl-= 2Co2++ Cl2↑+3H2O。
(3)在实验室里,萃取操作要用到的玻璃仪器主要有分液漏斗、烧杯;电池充电时的总反应为Ni(OH)2+M![]() NiOOH+MH,放电时正极发生还原反应,所以正极的电极反应式为:NiOOH+e-+H+= Ni(OH)2;综上所述,本题答案是:分液漏斗、烧杯;NiOOH+e-+H+= Ni(OH)2。
NiOOH+MH,放电时正极发生还原反应,所以正极的电极反应式为:NiOOH+e-+H+= Ni(OH)2;综上所述,本题答案是:分液漏斗、烧杯;NiOOH+e-+H+= Ni(OH)2。
(4)根据流程可知:含有Co2+离子的溶液中加入碳酸氢铵和氨水,反应生成Co2(OH)2CO3;沉钴时发生反应的离子方程式为:2 Co2++HCO3-+3NH3H2O=Co2(OH)2CO3+3NH4++H2O;在空气中煅烧Co2(OH)2CO3,反应生成Co2O3和CO2,化学方程式为:2Co2(OH)2CO3+O2![]() 2Co2O3+2CO2+2H2O;综上所述,本题答案是:2Co2++HCO3-+3NH3H2O=Co2(OH)2CO3+3NH4++H2O;2Co2(OH)2CO3+O2
2Co2O3+2CO2+2H2O;综上所述,本题答案是:2Co2++HCO3-+3NH3H2O=Co2(OH)2CO3+3NH4++H2O;2Co2(OH)2CO3+O2![]() 2Co2O3+2CO2+2H2O 。
2Co2O3+2CO2+2H2O 。

【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①该条件下反应的平衡常数为______;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为______mol·L-1。
②下列措施中能使平衡时 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉