题目内容
【题目】将2×10- 5mol/LKCl 与2×10- 5mol/LAgNO3溶液等体积混合,下列说法正确的是 (已知AgCl 的Ksp=1.8×10-10 )
A.有AgCl沉淀析出B.无AgCl沉淀析出
C.无法确定有无AgCl沉淀析出D.有沉淀但不是AgCl
【答案】B
【解析】
将2×10- 5mol/LKCl 与2×10- 5mol/LAgNO3溶液等体积混合,溶液中氯离子和银离子的浓度分别都是1×10- 5mol/L,此时c(Ag+)·c(Cl-)=1×10-10<1.8×10-10 ,所以没有沉淀析出;
答案选B。

【题目】在密闭容中加入2.0molSO2和1.0molO2,一定条件下发生如下反应2SO2+O2![]() 2SO3。反应达到平衡后,各物质的物质的量可能为( )
2SO3。反应达到平衡后,各物质的物质的量可能为( )
n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
A | 2.0 | 1.0 | 0 |
B | 1.0 | 0.8 | 1.0 |
C | 0.20 | 0.10 | 1.80 |
D | 0 | 0 | 2.0 |
A. AB. BC. CD. D
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ/mol,CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(g)ΔH=-a kJ/mol,则 a___238.6(填“>”、“<”或“=”)。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:_________________________________。
(3)反应mA(g)+nB(g)![]() pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
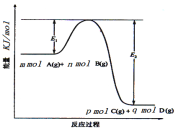
该反应△H =____(用含E1、E2式子表示);在反应体系中加入催化剂,E1___,E2___,(填增大、减小、不变)。
(4)已知:CO (g) +H2O (g)![]() H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
回答下列问题:
①该反应的ΔH=__________填“>”、“=”或“<”)。
②已知在一定温度下,C(s) +CO2 (g)![]() 2CO(g)平衡常数K1;C (s) +H2O (g)
2CO(g)平衡常数K1;C (s) +H2O (g)![]() CO(g) +H2 (g)平衡常数K2。则K、K1 、K2之间的关系是__________________________。
CO(g) +H2 (g)平衡常数K2。则K、K1 、K2之间的关系是__________________________。