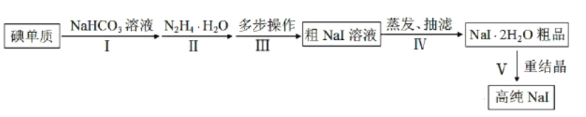
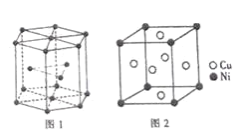
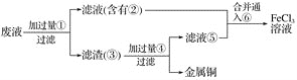
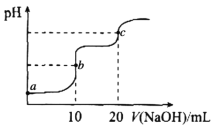
题目内容
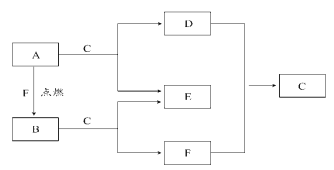
【题目】A、D、F均是常见元素组成的单质,B是淡黄色固体,常温下C是液体。
请回答下列问题:
(1)B和E的化学式:B__,E___。
(2)A与C反应的离子方程式为___;A与F生成B的化学方程式为___。
(3)关于A的叙述中正确的是___(填序号)。
①A有很强的还原性 ②A的焰色反应呈紫色
③少量A可以保存在冷水里 ④A着火时应用细沙盖灭
(4)将A、镁、铝各0.3mol分别放入100mL1mol/L的盐酸中,同温同压下产生的气体体积之比是__。
①1∶2∶3 ②6∶3∶2 ③3∶1∶1 ④1∶1∶1
【答案】Na2O2 NaOH 2Na+2H2O=2Na++2OH-+H2↑ 2Na+O2![]() Na2O2 ①④ ③
Na2O2 ①④ ③
【解析】
A、F均是常见元素组成的单质,点燃时,生成B是淡黄色固体,则B为过氧化钠;A与常温下是液体的C反应,可确定A为Na,C为水,则F为氧气;D为氢气,E为NaOH。
(1)分析可知,B为过氧化钠,E为氢氧化钠,化学式分别为Na2O2、NaOH;
(2)钠与水反应生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑;钠与氧气反应生成过氧化钠,方程式为2Na+O2![]() Na2O2;
Na2O2;
(3)①A为Na,很容易失去最外层一个电子,有很强的还原性,①叙述正确;
②A的焰色反应呈黄色,②叙述错误;
③钠与水反应,A不能保存在冷水里,③叙述错误;
④Na与细沙不反应,且能隔绝空气,则着火时应用细沙盖灭,④叙述正确;
答案为①④;
(4)Na除能与盐酸反应生成氢气外,还能与水反应生成氢气,则Na生成氢气的量为0.15mol;100mL1mol/L盐酸中含有氢离子为0.1mol,则镁、铝只能生成0.05mol氢气,则生成氢气的物质的量之比为0.15:0.05:0.05=3:1:1,答案为③。

【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是___。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是__。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下移动
(3)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___________ |
2 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似地认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=__(取小数点后一位)。