题目内容
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的常用试剂是___,证明Fe3+存在的现象是____,配制含Fe2+的溶液时,常常向溶液中加入少量___,使被氧气氧化形成的Fe3+还原为Fe2+。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:___。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
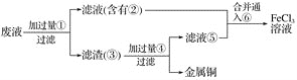
A.请写出上述实验中加入或生成的有关物质的化学式。
①___,②___,③___,④____,⑤____,⑥_____。
B.请写出相关反应的化学方程式。_______。
【答案】KSCN溶液 溶液变成红色 铁粉 2FeCl3+Cu=2FeCl2+CuCl2 Fe FeCl2 Fe和Cu HCl FeCl2 Cl2 CuCl2+Fe=FeCl2+Cu、2FeCl3+Fe=3FeCl2、Fe+2HCl=FeCl2+H2↑、2FeCl2+Cl2=2FeCl3
【解析】
(1)检验溶液中Fe3+存在通常用KSCN溶液,溶液变红说明Fe3+存在;Fe2+容易被空气中的氧气氧化,为了防止亚铁离子被氧化,结合不能引入新杂质分析判断;
(2)铜与氯化铁反应生成氯化铜、氯化亚铁;
(3)反应中含有氯化亚铁、氯化铜和未反应的氯化铁,由工艺流程可知,滤渣③中含有金属铜,应是废液与过量的Fe反应,滤液②中含有氯化亚铁,滤渣③中含有金属铜、未反应的铁,加入盐酸,过滤,回收铜,滤液⑤中含有氯化亚铁,与滤液②合并,通入氯气可以得到氯化铁,据此分析解答。
(1)检验溶液中Fe3+存在通常用KSCN溶液,取少量溶液于试管中,滴加KSCN溶液,溶液变红说明存在Fe3+;配制含Fe2+的溶液时,为了防止亚铁离子被氧化,且不能引入新杂质,常加入铁粉(铁钉也可),使被氧气氧化形成的Fe3+还原为Fe2+,故答案为:KSCN溶液;溶液变红;铁粉;
(2)氯化铁与铜反应生成氯化亚铁与氯化铜,反应的化学方程式为:2FeCl3+Cu═2FeCl2+CuCl2,故答案为:2FeCl3+Cu═2FeCl2+CuCl2;
(3)A.废液中含有氯化亚铁、氯化铜和未反应的氯化铁,由工艺流程可知,滤渣③中含有金属铜,应是废液与过量的Fe反应,滤液②中含有氯化亚铁,滤渣③中含有金属铜和未反应的铁,加入盐酸,滤液⑤中也含有氯化亚铁,与滤液②合并后通入氯气可以得到氯化铁,故答案为:Fe;FeCl2;Fe、Cu;HCl;FeCl2;Cl2;
B.废液中加入铁粉,发生CuCl2+Fe=Cu+FeCl2、2FeCl3+Fe=3FeCl2;滤渣中含有铁、铜,加入盐酸,铁与盐酸反应,化学方程式为Fe+2HCl=FeCl2+H2↑,氯化亚铁与氯气的反应,化学方程式为2FeCl2+Cl2=2FeCl3,故答案为:CuCl2+Fe=Cu+FeCl2、2FeCl3+Fe=3FeCl2、Fe+2HCl=FeCl2+H2↑、2FeCl2+Cl2=2FeCl3。

 阅读快车系列答案
阅读快车系列答案【题目】向某密闭容器中充入NO2,发生反应2NO2(g)![]() N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
t/℃ | 27 | 35 | 49 | 70 |
NO2% | 20 | 25 | 40 | 66 |
N2O4% | 80 | 75 | 60 | 34 |
下列说法不正确的是( )
A.27℃,该平衡体系中的NO2转化率为![]()
B.平衡时,NO2的消耗速率为N2O4消耗速率的2 倍
C.室温时,将盛有NO2的密闭玻璃球放入冰水中其颜色会变浅
D.其他条件不变,增大NO2起始量,平衡正移,该反应的化学平衡常数增大