题目内容
【题目】据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成C的含氧化合物。请回答下列问题:
(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”(指能量相同的原子轨道在全满、半满、全空状态时,体系的能量最低),该原子的外围电子排布式为_____。
(2)在3d过渡金属中,基态原子未成对电子数最多的元素是_____(填元素符号)。
(3)铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为_____。
(4)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力_____ (“减弱”或“不变”)。铁晶体中粒子之间作用力类型是_____。
(5)常温下,H2O2氧化CH4生成CH3OH、HCHO、HCOOH等。
①它们的沸点分别为64.7℃、-19.5℃、100.8℃,其主要原因是_____;
②CH4和HCHO比较,键角较大的是_____,主要原因是_____。
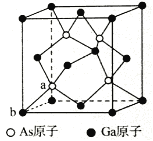
(6)钴晶胞和白铜(铜镍合金)晶胞分别如图1、2所示。
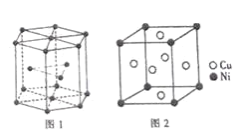
①钴晶胞堆积方式的名称为_____;
②已知白铜晶胞的密度为dg·cm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_____ pm(列出计算式)。
【答案】3d104s1 Cr 光谱分析 减弱 金属键 HCOOH、CH3OH存在氢键,且HCOOH中氢键更强,HCHO分子间存在范德华力,氢键比范德华力更强 HCHO CH4中C原子采取sp3杂化,HCHO中C原子采取sp2杂化 六方最密堆积 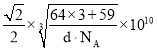
【解析】
(1)具有全充满、半充满、全空的电子构型的原子更稳定;
(2)在3d过渡金属中,基态原子未成对电子数最多的元素的价电子排布式为3d54s1;
(3)用原子光谱上的特征谱线来鉴定元素称为光谱分析;
(4)石墨烯限域单原子铁活化CH4分子中的C-H键,说明在催化剂条件下C-H更容易发生断裂,其键能降低;铁晶体属于金属晶体,晶体中存在自由电子和金属阳离子,靠金属键结合形成金属单质;
(5)①HCOOH、CH3OH存在氢键,且HCOOH中氢键更强,HCHO分子间存在范德华力,氢键比范德华力更强;
②CH4为正四面体构型,HCHO为平面三角形,键角主要由碳原子杂化方式决定;
(6)①由图1所示,可知钴晶胞的堆积方式是六方最密堆积;
②面心6个Cu原子构成正八面体,棱上2个Cu原子与体心连线形成等腰直角三角形,该等腰直角三角形的斜边长即为两个面心上铜原子最短核间距,由几何知识可知两个面心上铜原子最短核间距=直角边长度的![]() 倍,而等腰直角三角形的直角边长等于晶胞棱长的
倍,而等腰直角三角形的直角边长等于晶胞棱长的![]() ,均摊法计算晶胞中Cu、Ni原子数目,计算晶胞质量,结合晶胞质量=晶体密度×晶胞体积计算晶胞棱长。
,均摊法计算晶胞中Cu、Ni原子数目,计算晶胞质量,结合晶胞质量=晶体密度×晶胞体积计算晶胞棱长。
(1)具有全充满、半充满、全空的电子构型的原子更稳定,在Mn、Fe、Co、Ni、Cu的外围电子排布式分别为3d54s2、3d64s2、3d74s2、3d84s2、3d104s1,某基态原子Cu原子核外电子排布遵循“洪特规则特例”;
(2)在3d过渡金属中,基态原子未成对电子数最多的元素的价电子排布式为3d54s1,该元素为Cr;
(3)用原子光谱上的特征谱线来鉴定元素称为光谱分析;
(4)石墨烯限域单原子铁活化CH4分子中的C-H键,说明在催化剂条件下C-H更容易发生断裂,其键能降低,即导致C与H之间的作用力减弱;铁晶体属于金属晶体,晶体中存在自由电子和金属阳离子,靠金属键结合形成金属单质;
(5)①HCOOH、CH3OH存在氢键,且HCOOH中氢键更强,HCHO分子间存在范德华力,氢键比范德华力更强,故沸点HCOOH>CH3OH>HCHO;
②CH4中C原子采取sp3杂化,为正四面体构型,HCHO中C原子采取sp2杂化,为平面三角形,HCHO中键角较大;
(6)①由图1所示,可知钴晶胞的堆积方式是六方最密堆积;
②面心6个Cu原子构成正八面体,棱上2个Cu原子与体心连线形成等腰直角三角形,该等腰直角三角形的斜边长即为两个面心上铜原子最短核间距,由几何知识可知两个面心上铜原子最短核间距=直角边长度的![]() 倍,而等腰直角三角形的直角边长等于晶胞棱长的
倍,而等腰直角三角形的直角边长等于晶胞棱长的![]() ,晶胞中Cu=6×
,晶胞中Cu=6×![]() =3、Ni原子数目=8×
=3、Ni原子数目=8×![]() =1,晶胞质量=
=1,晶胞质量=![]() g,设晶胞棱长为 a pm,则:dgcm-3×(a×10-10 cm)3=
g,设晶胞棱长为 a pm,则:dgcm-3×(a×10-10 cm)3=![]() g,解得a=
g,解得a=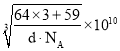 ,故两个面心上铜原子最短核间距=
,故两个面心上铜原子最短核间距=![]() ×(
×(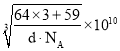 pm×
pm×![]() )=
)=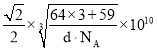 pm。
pm。

【题目】某学习小组用下列装置完成了探究浓硫酸和 SO2性质的实验(部分夹持装置已省略),下列“ 现象预测” 与“ 解释或结论” 均正确的是
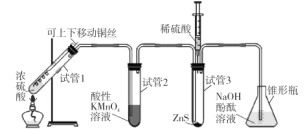
选项 | 仪器 | 现象预测 | 解释或结论 |
A | 试管1 | 有气泡、酸雾,溶液中有白色固体出现 | 酸雾是SO2所形成,白色固体是硫酸铜晶体 |
B | 试管2 | 紫红色溶液由深变浅,直至褪色 | SO2具有还原性 |
C | 试管3 | 注入稀硫酸后,没有现象 | 由于Ksp(ZnS)太小,SO2与ZnS在注入稀硫酸后仍不反应 |
D | 锥形瓶 | 溶液红色变浅 | NaOH溶液完全转化为NaHSO3溶液,NaHSO3溶液碱性小于NaOH |
A.AB.BC.CD.D