题目内容
下列离子方程式中正确的是
| A.FeO溶于稀硝酸中:FeO+2H+ = Fe2++H2O |
| B.过量CO2通入NaOH溶液中:OH¯+CO2 = HCO3¯ |
| C.金属钠溶于水中:Na+H2O = Na++OH¯+H2↑ |
| D.过量氨水加入AlCl3溶液中:Al3++3OH¯= Al(OH)3↓ |
B
解析试题分析:稀硝酸不仅有强酸性,而且具有强氧化性,它能将亚铁离子氧化为铁离子,亚铁离子能将稀硝酸还原为一氧化氮气体,因此氧化亚铁溶于稀硝酸的原理为: 3FeO+10H++NO3¯=3Fe3++NO↑+5H2O,故A错误;过量二氧化碳与氢氧化钠反应生成碳酸氢钠,故B正确;钠元素化合价升高总数、氢元素化合价降低总数分别是1、2,违反电子守恒原理,钠溶于水的原理为2Na+2H2O = 2Na++2OH¯+H2↑,故C错误;一水合氨是弱碱,不能完全电离,不能用氢氧根离子表示,则过量氨水加入氯化铝溶液的原理为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故D错误。
考点:考查离子方程式,涉及元素化合物的主要性质、氧化还原反应等。

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
下列离子方程式正确的是
| A.向AlCl3溶液中滴加氨水:Al3++3OH-=Al(OH)3↓ |
| B.向NaHCO3溶液中加入少量Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
C.向苯酚溶液中滴加Na2CO3溶液: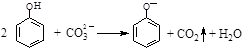 |
| D.向氯化亚铁溶液中滴加稀硝酸:3Fe2++4H++ NO3-= 3Fe3++NO↑+2H2O |
下列表示对应化学反应的离子方程式正确的是
| A.漂白粉露置在空气中:ClO-+CO2+H2O=HClO+HCO3- |
| B.用过量氨水吸收二氧化硫:SO2+NH3·H2O=HSO3-+NH4+ |
| C.用足量的氢氧化钠溶液吸收二氧化氮:3NO2+2OH-=2NO3-+NO+H2O |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: |
下列离子方程式与所述事实相符且正确的是
| A.向稀氨水中逐滴加入稀硝酸银溶液配制银氨溶液:Ag++2NH3·H2O="[Ag" (NH3)2] ++2 H2O |
| B.用双氧水和稀硫酸可以蚀刻印刷电路板:Cu+H2O2+2H+=Cu2++2H2O |
C.硫化钾晶体溶于水:S2-+2H2 O 2OH-+H2S 2OH-+H2S |
| D.澄清石灰水与过量苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
下列各组离子能大量共存的是
| A.加入KSCN显红色的溶液中:K+、NH4+、Cl―、I― |
| B.含“84”消毒夜(有效成分NaClO)的溶液中:Fe2+、Cl―、Ca2+、Na+ |
| C.常温下,pH=1的溶液中:NH4+、Na+、Cl―、Cu2+ |
| D.常温下,pH=13的无色溶液中:K+、NO3―、HCO3―、Al3+ |
在室温下,下列各组微粒在溶液中能大量共存的是
| A.Na+、Ba2+、OH-、Cl- | B.H+、Fe2+、ClO-、SO42- |
| C.K+、Fe3+、C6H5O-、SCN- | D.NH4+、Al3+、SiO32-、CO32- |
在无色水溶液中能大量共存的一组离子是
| A.Na+、Ag+、Br-、MnO4- | B.K+、Al3+、AlO2-、SO42- |
| C.Fe3+、H+、I-、SO32- | D.Mg2+、NH4+、NO3-、Cl- |
下列离子方程式表达的反应事实正确的是
| A.Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O |
| B.向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓ |
| C.向碳酸钙中加入稀盐酸:CO32-+2H+=CO2↑+H2O |
| D.向Ca(ClO)2溶液中通入过量二氧化碳:ClO-+ H2O + CO2=" HClO" + HCO3- |
