题目内容
下列表示对应化学反应的离子方程式正确的是
| A.漂白粉露置在空气中:ClO-+CO2+H2O=HClO+HCO3- |
| B.用过量氨水吸收二氧化硫:SO2+NH3·H2O=HSO3-+NH4+ |
| C.用足量的氢氧化钠溶液吸收二氧化氮:3NO2+2OH-=2NO3-+NO+H2O |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: |
D
解析试题分析:A不符合实事,最终生成CaCO3难溶物,不是碳酸氢钙,当然在离子反应中难溶物要写成化学式,不能拆分,错误。B氨水过量溶液呈碱性,生成正盐(NH4)2SO3,错误;C不符合反应实际,产物应生成亚硝酸根NO2-,错误;
考点:考查离子方程式的正误判断。

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
今有一混合物的水溶液,只可能肯有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀生成;
(2)第二份加足量NaOH溶液后,收集到气体0.05mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀4.3g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测正确的是
| A.K+可能存在 | B.混合溶液中c(CO32-)为1 mol/L |
| C.Cl-一定存在 | D.Ba2+一定不存在,Mg2+可能存在 |
下列微粒在溶液中能大量共存,通入SO2后仍能大量共存的一组是
| A.Ba2+、Na+、H+、Cl- | B.Na+、K+、SO32-、Cl- |
| C.Al3+、K+、Br-、HCO3- | D.Fe3+、Na+、H2O2、SO42- |
下列离子在溶液中能大量共存,通入SO2气体后仍能大量共存的一组是
| A.NH4+、I-、Cl-、Ca2+ | B.K+、Na+、ClO-、SO42- |
| C.Fe3+、Na+、Cl-、SCN- | D.K+、Al3+、NO3-、AlO2- |
下列离子或分子在溶液中能大量共存,加入足量Na2O2后仍能大量共存的是
| A.K+、Cl-、Na+、SO32- | B.Ba2+、NO3-、Al3+、Br- |
| C.K+、NH4+、I-、CO32- | D.Na+、Cu2+、NH3·H2O、SO42- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1mo1/L NaI溶液:K+、Na+、MnO4-、OH- |
| B.能溶解CaCO3的溶液:K+、NH4+、Cl-、NO3- |
| C.0.1mo1/LNaHSO3溶液:Na +、Mg2+、SO42-、ClO- |
| D.c(H+)/c(OH-)=1013,的溶液:K+、Fe2+、Cl-、NO3- |
下列各组离子中,在强碱性溶液中一定能共存的是
| A.Na+、NH4+、AlO2ˉ、SO42ˉ |
| B.Na+、Brˉ、SO42ˉ、Clˉ |
| C.K+、Na+、HCO3ˉ、NO3ˉ |
| D.K+、Clˉ、Al3+、CO32ˉ |
下列离子方程式中正确的是
| A.FeO溶于稀硝酸中:FeO+2H+ = Fe2++H2O |
| B.过量CO2通入NaOH溶液中:OH¯+CO2 = HCO3¯ |
| C.金属钠溶于水中:Na+H2O = Na++OH¯+H2↑ |
| D.过量氨水加入AlCl3溶液中:Al3++3OH¯= Al(OH)3↓ |
常温,相应条件下,下列各组离子一定能大量共存的是
| A.c(Al3+)=0.1mol/L的溶液中:Na+、K+、AlO2-、OH- |
| B.无色溶液中:K+、CH3COO-、HCO3-、MnO4- |
C.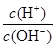 =1×1014的溶液:Ba2+、Na+、SO32-、NO3- =1×1014的溶液:Ba2+、Na+、SO32-、NO3- |
| D.通入足量CO2后所含离子还能大量共存的是:K+、Ca2+、NO3-、Cl- |