题目内容
8.下列推断符合实际的是( )| A. | 第n周期的最后一种金属元素处在第n-1族(1<n<7,n为正整数) | |
| B. | m=1和m=7(m为最外层电子数)的元素单质能形成的化合物都是离子化合物 | |
| C. | m-n=5(m为最外层电子数,n为电子层数)的主族元素存在最强的对应含氧酸 | |
| D. | 第n周期有n种主族金属元素(1<n<7,n为正整数) |
分析 A.可举反例证明错,如第2周期的最后一种金属元素为Be,处在第ⅡA族;
B.H和Cl形成的化合物为HCl,是共价化合物;
C.最强的含氧酸为HClO4,其中Cl元素最外层电子数-电子层数=4;
D.第2周期有2种主族金属元素为Li、Be,第3周期有3种主族金属元素为Na、Mg、Al,类推判断.
解答 解:A.第2周期的最后一种金属元素为Be,处在第ⅡA族,第3周期的最后一种金属元素为Al,处在第ⅢA族,故A错误;
B.H和Cl形成的化合物为HCl,是共价化合物,故B错误;
C.最强的含氧酸为HClO4,其中Cl元素最外层电子数-电子层数=4,故C错误;
D.第2周期有2种主族金属元素为Li、Be,第3周期有3种主族金属元素为Na、Mg、Al,类推知第n周期有n种主族金属元素,故D正确.
故选:D.
点评 本题考查了原子结构和性质,题目难度不大,注意根据实例分析判断,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列叙述正确的是( )
| A. | 在某反应中,当反应物具有的总能量大于生成物具有的总能量时,该反应吸热 | |
| B. | 同温同压下,4Al(s)+3O2(g)═2Al2O3(s)在常温和点燃条件下的△H不同 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l);△H=-53.7KJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于53.7kJ | |
| D. | 需要加热的化学反应一定是吸热反应 |
13.下列图象中的曲线正确的是( )
| A. | 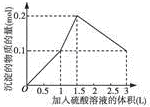 图A表示在1L含0.1mol NaAlO2和0.1mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.11mol•L-1H2SO4溶液,产生沉淀的物质的量与加入硫酸溶液体积的图象 | |
| B. | 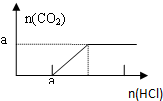 图B表示在分别含amol的Na2CO3和NaOH的混合溶液中逐滴滴加稀盐酸,产生气体 与加入盐酸体积的图象 | |
| C. | 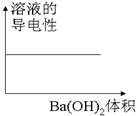 图C表示向100mL 0.1mol/L H2SO4溶液中,逐滴加入0.1mol/L Ba(OH)2溶液至过量, 溶液的导电性与加入 Ba(OH)2溶液体积的图象 | |
| D. | 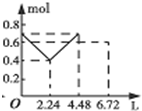 图D表示在往含0.2mol NaOH和0.1mol Ba(OH)2的溶液中持续稳定地通入CO2气体, 溶液中离子数目和通入CO2气体体积的图象(气体的溶解忽略不计) |
20.一定条件下,将A、B、C三种物质各1mol通入一个密闭容器中发生反应:2A+B?2C,达到化学反应限度时,B的物质的量可能是( )
| A. | 1.5 mol | B. | 1 mol | C. | 0.5 mol | D. | 0 |
18.下列各组物质的晶体中,晶体类型相同,化学键类型也完全相同的是( )
| A. | CO2和SiO2 | B. | CCl4和Fe | C. | CaCl2和HCl | D. | SO3和SO2 |
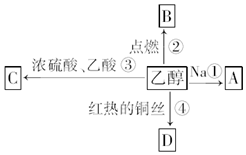 乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是有机物.
乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是有机物. CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O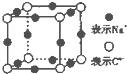 A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A~F为短周期主族元素,G为第四周期元素.已知:A是原子半径最小的元素,B和D同周期,固态的BD2能升华,E、F在B、D的下一周期,且E原子的最外层电子数与次外层电子数之比为3:4;G的质子数比F多12.请回答:
A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A~F为短周期主族元素,G为第四周期元素.已知:A是原子半径最小的元素,B和D同周期,固态的BD2能升华,E、F在B、D的下一周期,且E原子的最外层电子数与次外层电子数之比为3:4;G的质子数比F多12.请回答: ,NH4Cl的电子式
,NH4Cl的电子式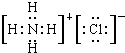 ;
;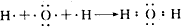 ;
;