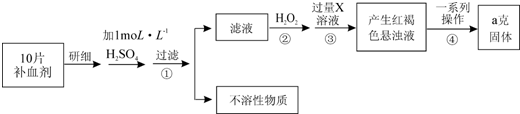
题目内容
2.下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如表所示| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
(2)根据反应 ①与 ②可推导出K1、K2与K3之间的关系,则K3=$\frac{K{\;}_{2}}{K{\;}_{1}}$(用K1、K2表示).
(3)反应 ③能进行的主要原因是该反应是放热反应.
(4)反应 ①达到平衡时再加入少量铁粉,平衡将不移动(填“正向移动”、“不移动”或“逆向移动”);铁的转化率将减小(填“增大”、“不变”或“减小”).
(5)要使反应 ③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有BD.
A.缩小反应容器的容积 B.升高温度
C.使用合适的催化剂 D.设法减少平衡体系中的CO的浓度
(6)若反应 ③的逆反应速率与时间的关系如图所示:
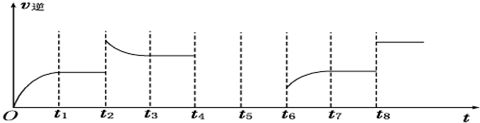
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时增大生成物的浓度; t8时增大压强或使用催化剂.
分析 (1)由表中数据可知,反应②中温度越高,平衡常数越小,说明升高温度平衡向逆反应方向移动;
(2)反应②-反应①得到反应③,则平衡常数K3为反应②与反应①的平衡常数商;
(3)反应①温度越高,平衡常数越大,反应②温度越高,平衡常数越小,而K3=$\frac{K{\;}_{2}}{K{\;}_{1}}$,故反应③温度越高,平衡常数越小,即正反应为放热反应;
(4)加入纯固体平衡不移动,据此分析;
(5)反应①温度越高,平衡常数越大,反应②温度越高,平衡常数越小,而K3=$\frac{K{\;}_{2}}{K{\;}_{1}}$,故反应③温度越高,平衡常数越小,即正反应为放热反应,结合平衡移动原理分析解答;
(6)①t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,该反应正反应是一个反应前后气体体积不变的吸热反应,不能是升高温度、增大压强,可能是增大生成物的浓度;
t8时反应速率增大,但平衡不移动,该反应正反应是一个反应前后气体体积不变的反应,可能为增大压强或使用催化剂;
解答 解:(1)由表中数据可知,反应②中温度越高,平衡常数越小,说明升高温度平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,故正反应为放热反应,
故答案为:放热;
(2)反应②-反应①得到反应③,则平衡常数K3为反应②与反应①的平衡常数商,故K3=$\frac{K{\;}_{2}}{K{\;}_{1}}$,
故答案为:$\frac{K{\;}_{2}}{K{\;}_{1}}$;
(3)反应①温度越高,平衡常数越大,反应②温度越高,平衡常数越小,而K3=$\frac{K{\;}_{2}}{K{\;}_{1}}$,故反应③温度越高,平衡常数越小,即正反应为放热反应,所以反应 ③能进行的主要原因是该反应是放热反应,故答案为:该反应是放热反应;
(4)因为铁粉为纯固体,所以反应 ①达到平衡时再加入少量铁粉,平衡将不移动;铁的转化率将减小,故答案为:不移动;减小;
(5)反应①温度越高,平衡常数越大,反应②温度越高,平衡常数越小,而K3=$\frac{K{\;}_{2}}{K{\;}_{1}}$,故反应③温度越高,平衡常数越小,即正反应为放热反应,
A.缩小反应容器的容积,压强增大,反应前后气体体积不变,平衡不移动,故A错误;
B.升高温度,平衡向逆反应方向移动,故B正确;
C.使用合适的催化剂,同等程度加快反应速率,平衡不移动,故C错误;
D.设法减小平衡体系中的CO的浓度,平衡向逆反应方向移动,故D正确;
故选:BD;
(6)①t2时逆反应速率增大,然后逆反应速率减低,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,该反应正反应是一个反应前后气体体积不变的吸热反应,不能是升高温度、增大压强,可能是增大生成物的浓度;
t8时反应速率增大,但平衡不移动,该反应正反应是一个反应前后气体体积不变的反应,可能为增大压强或使用催化剂,
故答案为:增大生成物的浓度;增大压强或使用催化剂.
点评 本题考查化学平衡常数、化学平衡与化学反应速率的影响因素、速率-时间图象等,侧重考查学生的分析能力,题目难度中等.

| A. | 分子中有C=C双键 | B. | 分子中没有C=C双键 | ||
| C. | 分子可能有C=C双键 | D. | 分子中可能只含单键 |
| A. | 液态HCl | B. | 熔融的NaOH | C. | KNO3溶液 | D. | FeCl3晶体 |
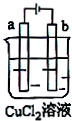
| A. | 电极a表面呈红色 | |
| B. | 电极b作阳极 | |
| C. | 电子由电源的正极沿导线流向电极a | |
| D. | 该装置能量转化形式为电能转化为化学能 |
| A. | 适当加热新制的氯水时,溶液的pH逐渐减小 | |
| B. | 加催化剂,使N2和H2在一定条件下转化为NH3 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | 增大压强,有利于SO2与O2反应生成SO3 |
| A. | C2H6 | B. | C2H4 | C. | C2H2 | D. | C2H6O |
①CaO(s)+H2O(1)═Ca(OH)2(aq);△H1
②CaO(s)+2HCl(g)═CaCl2(s)+H2O(1);△H2
③NH3(g)+HCl(g)═NH4Cl(s);△H3
④Ca(OH)2(aq)+2NH4Cl(s)═CaCl2(aq)+2NH3(g)+2H2O(1);△H4>0
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>0 | B. | △H4=△H1-△H2-2△H3 | ||
| C. | △H4=△H2-△H1-2△H3 | D. | △H4-△H1-△H2<0 |