题目内容
11.等质量的下列物质分别完全燃烧,生成CO2的量最多的是( )| A. | C2H6 | B. | C2H4 | C. | C2H2 | D. | C2H6O |
分析 烃完全燃烧生成二氧化碳与水,根据碳元素守恒可知,烃含碳质量分数越大,等质量烃燃烧时生成CO2越多.
解答 解:烃完全燃烧生成二氧化碳与水,根据碳元素守恒可知,烃含碳质量分数越大,等质量烃燃烧时生成CO2越多,
A.C2H6中C、H原子数目之比为2:6=1:3;
B.C2H4中C、H原子数目之比为2:4=1:2;
C.C2H2中C、H原子数目之比为2:2=1:1;
D.C2H6O中碳质量分数小于A;
故C2H2中碳元素的质量分数最大,相同质量烃燃烧,C2H2生成二氧化碳最多,
故选:C.
点评 本题考查化学方程式计算,涉及烃燃烧反应,注意利用碳元素守恒解答,避免利用化学反应方程式的繁琐,简化了计算过程.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.如图所示装置中,发生反应的离子方程式为Cu+2H+═Cu2++H2↑,下列说法正确的是( )
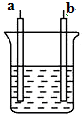

| A. | a、b不可能是同种材料的电极 | |
| B. | 该装置可能是电解池,电解质溶液为稀H2SO4 | |
| C. | 该装置可能是原电池,电解质溶液为稀HNO3 | |
| D. | 反应一段时间后,断开电路,向溶液中通入H2可使溶液复原 |
2.下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如表所示
请回答:(1)反应 ②是放热(填“吸热”或“放热”)反应.
(2)根据反应 ①与 ②可推导出K1、K2与K3之间的关系,则K3=$\frac{K{\;}_{2}}{K{\;}_{1}}$(用K1、K2表示).
(3)反应 ③能进行的主要原因是该反应是放热反应.
(4)反应 ①达到平衡时再加入少量铁粉,平衡将不移动(填“正向移动”、“不移动”或“逆向移动”);铁的转化率将减小(填“增大”、“不变”或“减小”).
(5)要使反应 ③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有BD.
A.缩小反应容器的容积 B.升高温度
C.使用合适的催化剂 D.设法减少平衡体系中的CO的浓度
(6)若反应 ③的逆反应速率与时间的关系如图所示:
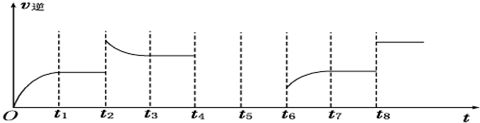
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时增大生成物的浓度; t8时增大压强或使用催化剂.
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
(2)根据反应 ①与 ②可推导出K1、K2与K3之间的关系,则K3=$\frac{K{\;}_{2}}{K{\;}_{1}}$(用K1、K2表示).
(3)反应 ③能进行的主要原因是该反应是放热反应.
(4)反应 ①达到平衡时再加入少量铁粉,平衡将不移动(填“正向移动”、“不移动”或“逆向移动”);铁的转化率将减小(填“增大”、“不变”或“减小”).
(5)要使反应 ③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有BD.
A.缩小反应容器的容积 B.升高温度
C.使用合适的催化剂 D.设法减少平衡体系中的CO的浓度
(6)若反应 ③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时增大生成物的浓度; t8时增大压强或使用催化剂.
6.下列热化学方程式中,能够表示物质燃烧热的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5 kJ/mol | |
| B. | H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ/mol | |
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8 kJ/mol | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-5518 kJ/mol |
16.有关反应的离子方程式书写错误的是( )
| A. | Cl2通入NaOH溶液中 Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 硫化亚铁与稀硫酸反应 FeS+2H+═Fe2++H2S↑ | |
| C. | 硫酸铵和氢氧化钡溶液 Ba2++SO42-═BaSO4↓ | |
| D. | 氢氧化钡与稀硫酸反应 Ba2++SO42-+2H++2OH-═BaSO4↓+2H2O |
20.化学与生产、生活息息相关,下列叙述错误的是( )
| A. | 铝罐可久盛食醋 | |
| B. | 氢氧化铝可作胃酸的中和剂 | |
| C. | 铁表而镀锌可以增强其抗腐蚀性 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
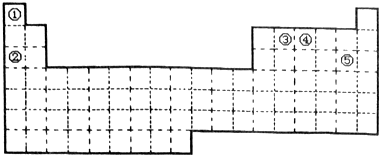
 .
.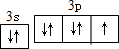 ,其单质在常温下为黄绿色的气体,实验中可以用NaOH溶液吸收,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
,其单质在常温下为黄绿色的气体,实验中可以用NaOH溶液吸收,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.