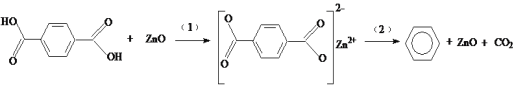
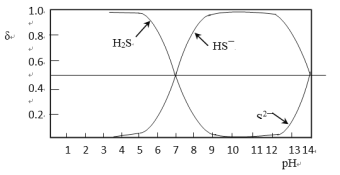
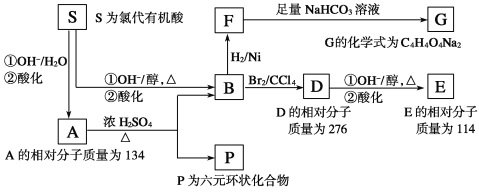
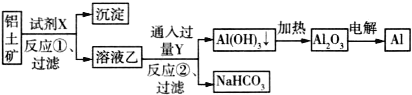
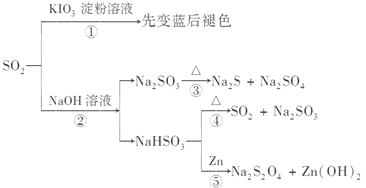
题目内容
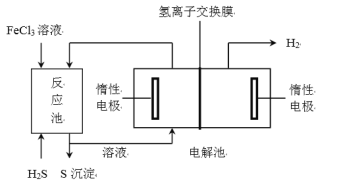
【题目】已知Cl2+2I=2C1-+I2为验证Fe3+、I2氧化性的相对强弱。某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,关闭活塞a。
Ⅳ.打开活塞b,将C中的溶液滴入D中,关闭活塞b,取下D振荡、静置。
请回答下列问题:
(1)A中产生黄绿色气体,写出A中发生反应的离子方程式___。
(2)验证氯气的氧化性强于碘单质的实验现象是___。
(3)B中通入氯气溶液变黄的离子方程式是;再向B中滴加KSCN溶液,溶液变红的离子方程式是___。
(4)C中的溶液滴入D中,振荡、静置,若产生现象,则说明Fe3+的氧化性强于碘单质,对应反应的离子方程式是___。有人认为这个实验设计存在缺陷,其理由是___。
(5)浸有氢氧化钠溶液的棉花作用是___。
【答案】2H++Cl-+ClO-=Cl2↑+H2O 湿润的淀粉KI试纸变蓝 Cl2+2Fe2+=2Fe3++2Cl- Fe3++3SCN-![]() Fe(SCN)3 静置后CCl4层溶液变为紫色,2I-+2Fe3+=2Fe2++I2。C的黄色溶液中可能含有过量的Cl2或产生的ClO-,也可将碘离子氧化为碘单质造成干扰 吸收多余的氯气,防止污染空气
Fe(SCN)3 静置后CCl4层溶液变为紫色,2I-+2Fe3+=2Fe2++I2。C的黄色溶液中可能含有过量的Cl2或产生的ClO-,也可将碘离子氧化为碘单质造成干扰 吸收多余的氯气,防止污染空气
【解析】
向A中的84消毒液中滴加浓盐酸产生黄绿色气体,该黄绿色气体为Cl2,反应的化学方程式为NaClO+2HCl(浓)= NaC1+Cl2↑+H2O,生成的氯气与碘单质发生反应,湿润的淀粉KI试纸变蓝,其化学方程式为:CI2+2KI=2KCl+I2↓;而后氯气将Fe2+氧化成Fe3+,最后Fe3+与I-反应:2Fe3++2I-=I2+2Fe2+。
(1)84消毒液的有效成分为NaClO,向A中的84消毒液中滴加浓盐酸产生黄绿色气体,该黄绿色气体为Cl2,反应的化学方程式为NaClO+2HCl(浓)= NaC1+Cl2↑+H2O,所以A中离子方程式为:2H++Cl-+ClO-=Cl2↑+H2O;
(2)根据装置图中的试剂,验证氯气的氧化性强于碘单质的实验现象是:湿润的淀粉KI试纸变蓝,发生反应的化学方程式为:CI2+2KI=2KCl+I2↓;
(3)B中的溶液变为黄色,B中反应为Cl2将Fe2+氧化成Fe3+,B中发生反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;再向B中滴加KSCN溶液,溶液变红的离子方程式是: Fe + 3SCN =Fe(SCN) (血红色);
(4)将C中溶液滴入D中,关闭活塞b,取下D振荡,若产生现象:静置后CCl4层溶液变为紫色,则说明Fe3+的氧化性强于碘单质,反应的离子方程式为2Fe3++2I-=I2+2Fe2+;但C的黄色溶液中可能含有过量的Cl2或产生的ClO-,也可将碘离子氧化为碘单质造成干扰,此为实验设计存在缺陷,要验证Fe3+的氧化性强于I2必须排除Cl2的干扰;
(5)由于Cl2有毒会污染大气,浸有NaOH溶液的棉花作用是:吸收氯气等有毒气体,防止污染空气,发生反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。

【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z
2Z
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 升高温度平衡常数增大,则此反应为吸热反应