题目内容
【题目】如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是
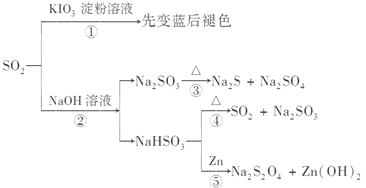
A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应③④⑤均属于氧化还原反应
D.工业上可利用反应②和反应④回收SO2
【答案】D
【解析】
A.反应①中先变蓝后褪色显然是因为KIO3的还原产物先是I2后是I-,体现了SO2具有还原性,反应②属于酸性氧化物和碱的反应,体现了SO2具有酸性,故A错误;
B.根据元素守恒,当n(Na2SO3):n(NaHSO3)=1:1时,n(SO2):n(NaOH)=2:3,故B错误;
C.反应④是非氧化还原反应,故C错误;
D.反应②吸收了二氧化硫,反应④放出了SO2,可以通过2个反应回收二氧化硫,故D正确;
故选D。

【题目】富马酸亚铁,是一种治疗缺铁性贫血的安全有效的铁制剂。富马酸在适当的pH条件下与FeSO4反应得富马酸亚铁。
已知:
物质名称 | 化学式 | 相对分子质量 | 电离常数(25℃) |
富马酸 | C4H4O4 | 116 | K1=9.5×10-4,K2=4.2×10-5 |
碳酸 | H2CO3 | K1=4.4×10-7,K2=4.7×10-11 | |
富马酸亚铁 | FeC4H2O4 | 170 |
i.制备富马酸亚铁:
①将富马酸置于100 mL烧杯A中,加热水搅拌
②加入Na2CO3溶液10 mL使溶液pH为6.5~6.7。并将上述溶液移至100 mL容器B中
③安装好回流装置C,加热至沸。然后通过恒压滴液漏斗D缓慢加入FeSO4溶液30 mL
④维持反应温度100℃,充分搅拌1.5小时。冷却,减压过滤,用水洗涤沉淀
⑤最后水浴干燥,得棕红(或棕)色粉末,记录产量。
请回答以下问题:
(1)该实验涉及到的主要仪器需从以下各项选择,则B为_________(填字母),C为___________(填名称);

(2)己知反应容器中反应物FeSO4和富马酸按恰好完全反应的比例进行起始投料,写出步骤②中加入Na2CO3溶液调节pH的目的是_____________,若加入Na2CO3溶液过量,对实验的影响是_____________;
(3)所需FeSO4溶液应现用现配,用FeSO4·7H2O固体配置FeSO4溶液的方法为:__________;
(4)写出容器B中制备富马酸亚铁的化学方程式:___________;
(5)步骤④检验沉淀是否洗净的方法是:________________;
ii. 计算产品的产率:
(6)经测定,产品中富马酸亚铁的纯度为76.5%、以5.80 g富马酸为原料反应制得产品8.50 g,则富马酸亚铁的产率为______________%(保留小数点后一位)。