题目内容
4.下列溶液中微粒的关系不正确的是( )| A. | 已知A-+H2B(过量)═HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| C. | 浓度为0.1mol•L-1 的下列溶液,pH由大到小的排列顺序:NaOH>Na2CO3 >(NH4)2SO4 >NaHSO4 | |
| D. | 为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸,若pH<7,则H2A是强酸 |
分析 A、A-+H2B(过量)═HA+HB-,酸性:H2B>HA,但无法比较的HA和HB-的酸性的强弱,酸性越强,其阴离子结合质子的能力越弱;
B、碱的强弱不知,若为强酸、强碱混合,呈中性,若为强酸、弱碱混合,则相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合显碱性;
C、根据溶液的酸碱性以及利用盐类的水解程度来确定溶液中pH大小,酸的酸性越弱则酸的酸根离子水解程度越大,其相同浓度盐溶液的pH越大;
D、若NaHA溶液的pH<7,H2A也可能是弱酸.
解答 解:A、A-+H2B(过量)═HA+HB-,酸性:H2B>HA,但无法比较的HA和HB-的酸性的强弱,酸性越强,其阴离子结合质子的能力越弱,所以只能HB-结合氢离子的能力弱于A-,故A错误;
B、pH=3硫酸,c(H+)=0.001mol/L,硫酸完全电离,pH=11一元碱BOH,c(OH-)=0.001mol/L,若为强酸、强碱混合,混合后溶液呈中性,若为强酸、弱碱混合,氢离子和氢氧根离子正好反应生成盐和水,而弱碱存在电离平衡,平衡右移,还可以继续电离出氢氧根离子,所以溶液呈碱性,故B正确;
C、氢氧化钠是强碱,其溶液呈强碱性,pH>7,相同浓度的氢氧化钠和碳酸钠,氢氧化钠的pH大于碳酸钠,而硫酸氢钠直接电离产生氢离子,硫酸铵水解呈酸性,所以硫酸氢钠的PH小于硫酸铵,综上pH由大到小的排列顺序:NaOH>Na2CO3 >(NH4)2SO4 >NaHSO4,故C正确;
D、若NaHA溶液的pH<7,H2A也可能是弱酸,如亚硫酸氢钠溶液呈酸性,但亚硫酸是弱酸,故D错误;
故选:AD.
点评 本题考查盐类水解及弱电解质电离,明确溶质的性质、外界条件对化学平衡的影响再结合物料守恒、电荷守恒即可解答离子浓度大小的问题,综合性强,有一定的难度.

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案| A. | 甲烷与氯气在光照条件下的反应和乙酸与乙醇生成乙酸乙酯的反应均属于取代反应 | |
| B. | 顺-2-丁烯和反-2-丁烯的熔、沸点不相同 | |
| C. | C4H9Br的同分异构体有3种 | |
| D. | 乙烯、苯分子中的所有原子都在同一平面上 |
| A. | 简单离子半径:W>Y>Z | |
| B. | X与Y可形成既含极性键又含非极性键的化合物 | |
| C. | Z与W形成的化合物一定是离子化合物 | |
| D. | Y的氧化物对应的水化物的酸性一定比W的弱 |
| A. | HCHO | B. | CH3CH2OH | C. | HCOOH | D. | HCOOCH3 |
| A. | 分子中的C、H、O的个数比为1:2:3 | B. | 该有机物的相对分子质量为14 | ||
| C. | 该分子中肯定不含氧元素 | D. | 分子中C、H个数比为1:2 |
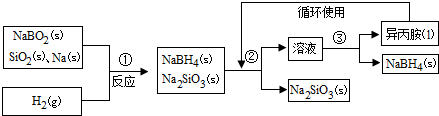
 .
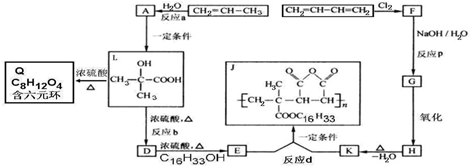
. ;L→Q
;L→Q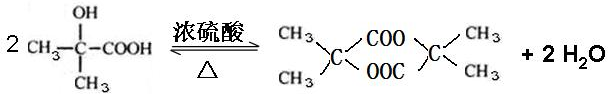 .
.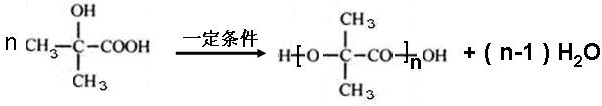 .
.