题目内容
15.汽车是现代社会重要的交通工具,它造福于人类,但同时对自然生态环境的恶化有难以推卸的责任.(1)设汽油的成分是辛烷,相同的条件下辛烷气与空气的体积比是V,要使辛烷恰好完全燃烧,V的最大值Vmax=0.016(空气中的氧气的体积分数按20%计算);
(2)若辛烷与空气的体积比小于(1)中的Vmax,则汽车尾气中增多的有害气体是NO、NO2;
(3)CO与NO是汽车尾气中的有害气体,它们在催化转化器中能反应生成完全无毒的物质,试写出它们反应的化学方程式2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
分析 (1)根据方程式计算出辛烷与氧气恰好反应时,辛烷与空气的体积比有最大值;
(2)辛烷与空气体积比<V时,氧气过量,会产生NO、NO2;
(3)CO与NO反应,生成无毒气体为氮气和二氧化碳.
解答 解:(1)由辛烷完全燃烧2C8H18+25O2$\stackrel{点燃}{→}$16CO2+18H2O,则$\frac{V({C}_{8}{H}_{18})}{\frac{1}{5}V(空气)}$=$\frac{2}{25}$,所以,V=$\frac{V(辛烷)}{V(空气)}$=$\frac{2}{25}×\frac{1}{5}$=0.016,故答案为:0.016;
(2)辛烷与空气体积比<V时,氧气过量,在放电条件下,发生反应N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,2NO+O2═2NO2,会产生NO、NO2有毒气体,污染大气,故答案为:NO、NO2;
(3)由信息可知,“催化转换器”使CO与NO反应,生成无毒气体为氮气和二氧化碳,该反应为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
点评 本题考查常见环境污染及治理,为高考常见题型和高频考点,注意信息的抽取和应用是解答本题的关键,侧重学生获取信息并处理信息能力的考查,题目难度不大.

练习册系列答案
相关题目
5.有科学家认为:硅是“21世纪的能源”、“未来的石油”,下列有关硅可能成为新型能源的依据的叙述中不正确的是( )
| A. | 自然界存在大量硅单质 | |
| B. | 自然界的硅易开采,且可再生 | |
| C. | 硅燃料便于运输、贮存,从安全角度考虑,硅是优质燃料 | |
| D. | 硅燃料燃烧放出的热量多,其燃烧产物对环境的污染容易有效地控制 |
6.某课外学习小组在学习了Na2O2与CO2的反应后,认为Na2O2与SO2应该也可以反应.他们设计了下图装置(夹持装置已略去,装置的气密性良好)进行实验,探究SO2与Na2O2反应的产物,请按要求回答下列问题.
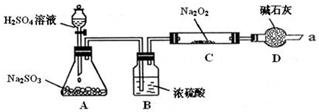
写出装置A中发生反应的化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以吸收尾气在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;假设2:只有Na2SO4;假设3:既有Na2SO3,又有Na2SO4.
(1)若假设1成立,写出SO2与Na2O2反应的化学方程式:2Na2O2+2SO2=2Na2SO3+O2↑.
(2)为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:

甲同学由此得出结论:产物是Na2SO4,该方案是否合理否否(填“是”或“否”),理由是硝酸有强氧化性,硝酸可以将BaSO3沉淀氧化为BaSO4
(3)乙同学设计了如下实验验证假设3成立,请帮助他完成下表.
步骤②中将产生的气体通入少量酸性KMnO4溶液中,发生反应的离子方程式为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.

写出装置A中发生反应的化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以吸收尾气在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;假设2:只有Na2SO4;假设3:既有Na2SO3,又有Na2SO4.
(1)若假设1成立,写出SO2与Na2O2反应的化学方程式:2Na2O2+2SO2=2Na2SO3+O2↑.
(2)为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:

甲同学由此得出结论:产物是Na2SO4,该方案是否合理否否(填“是”或“否”),理由是硝酸有强氧化性,硝酸可以将BaSO3沉淀氧化为BaSO4
(3)乙同学设计了如下实验验证假设3成立,请帮助他完成下表.
| 实验步骤 | 现象 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解. | 固体全部溶解 |
| ②向上试管中加入过量的稀盐酸,将产生的气体通入少量酸性KMnO4溶液中. | KMnO4溶液紫色褪去 |
| ③向步骤②反应后的试管中,加入适量的BaCl2溶液. | 产生白色沉淀 |
3.某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):(注意:氢气体积均在标准状况下测定的 )
①哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大2~3min,原因是该反应是放热反应,此时温度高.
②哪一段时段的反应速率最小4~5min,原因是H+浓度小.
③求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)0.1mol/(L•min).
④如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水、B.NaCl溶液、C.NaNO3溶液、D.CuSO4溶液、E.Na2CO3溶液,你认为可行的是AB.
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
②哪一段时段的反应速率最小4~5min,原因是H+浓度小.
③求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)0.1mol/(L•min).
④如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水、B.NaCl溶液、C.NaNO3溶液、D.CuSO4溶液、E.Na2CO3溶液,你认为可行的是AB.
10.下列有机物在核磁共振氢谱中只有1种信号峰的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
20.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),在2L的密闭容器中进行,1min后,NH3减少0.12mol,则该反应的化学反应速率是( )
| A. | v(NH3)=0.002mol(L•s) | B. | v(H2O)=0.002mol/(L•s) | ||
| C. | v(NO)=0.0015mol/(L•s) | D. | v(O2)=0.00125mol/(L•s) |
4.下列溶液中微粒的关系不正确的是( )
| A. | 已知A-+H2B(过量)═HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| C. | 浓度为0.1mol•L-1 的下列溶液,pH由大到小的排列顺序:NaOH>Na2CO3 >(NH4)2SO4 >NaHSO4 | |
| D. | 为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸,若pH<7,则H2A是强酸 |
20.下列各分子中,构成分子的原子不处在同一平面上的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 乙炔 | D. | 苯 |
 A、B、C、D、E原子序数依次增大,且为前四周期的元素,其中B2-和C+具有相同的核外电子排布;D的氢化物的沸点比其上一周期同族元素氢化物的沸点低;E核外有五个单电子,B、E形成的某种化合物和A、D形成的化合物的浓溶液加热时反应可用于实验时制取气态单质D.
A、B、C、D、E原子序数依次增大,且为前四周期的元素,其中B2-和C+具有相同的核外电子排布;D的氢化物的沸点比其上一周期同族元素氢化物的沸点低;E核外有五个单电子,B、E形成的某种化合物和A、D形成的化合物的浓溶液加热时反应可用于实验时制取气态单质D.