题目内容
9.某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物必须满足的条件是( )| A. | 分子中的C、H、O的个数比为1:2:3 | B. | 该有机物的相对分子质量为14 | ||
| C. | 该分子中肯定不含氧元素 | D. | 分子中C、H个数比为1:2 |
分析 某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,只能说明该有机物中含有C、H原子个数之比为1:2;题中条件无法确定该有机物是否含有氧元素,以此进行解答.
解答 解:A.燃烧产物为二氧化碳和水,无法确定该有机物中是否含有氧元素,故A错误;
B.根据题意只能确定该有机物中碳原子和氢原子的个数比,不能判断出该有机物中是否含有氧元素,就不能确定有机物的分子式以及相对分子式量的大小,故B错误;
C.题中信息无法确定有机物中是否含有氧元素,故C错误;
D.根据生成等物质的量的水和二氧化碳可知,该有机物分子中含有C、H的原子个数比为1:2,故D正确.
故选D.
点评 本题考查了有机物分子式的确定,题目难度不大,注意熟练掌握确定有机物分子式、结构简式的方法,明确无法确定是否含有氧元素是解答本题的关键.

练习册系列答案
相关题目
4.下列溶液中微粒的关系不正确的是( )
| A. | 已知A-+H2B(过量)═HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| C. | 浓度为0.1mol•L-1 的下列溶液,pH由大到小的排列顺序:NaOH>Na2CO3 >(NH4)2SO4 >NaHSO4 | |
| D. | 为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸,若pH<7,则H2A是强酸 |
20.下列各分子中,构成分子的原子不处在同一平面上的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 乙炔 | D. | 苯 |
4.下列描述正确的是( )
| A. | 氯气、SO2都能使品红溶液褪色,它们的漂白原理相同 | |
| B. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、I-可能大量共存 | |
| C. | 某溶液中加入盐酸酸化的氯化钡产生白色沉淀,原溶液中一定含有SO42- | |
| D. | Fe(NO3)2溶液中滴加少量稀硫酸会变黄色 |
14.下列反应起了氮的固定作用的是( )
| A. | NH3经催化氧化获得NO | B. | NO2跟水作用制取硝酸 | ||
| C. | NH3+CO2+H2O=NH4HCO3 | D. | N2+O2=2NO(放电条件) |
1.为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,则下列叙述正确的是( )
| A. | 中性溶液的 AG=0 | B. | 酸性溶液的AG<0 | ||
| C. | 常温下0.1mol/LNaOH溶液的AG=12 | D. | 常温下0.1mol/L盐酸溶液的AG=12 |
18.现有T、X、Y、W、M原子序数依次增大的短周期元素,常温、常压下,Y有两种常见的气态单质,其中一种成为环境监测新增标准,T、Y与X相邻,W的所有盐都易溶于水且日常生活中存在W的盐,M的氢氧化物在水中存在两种电离方式.加入酸或碱,都能使电离平衡发生移动,下列有关说法正确的是( )
| A. | T、W、M的最高价氧化物的水化物相互反应 | |
| B. | T、Y、W组成的化合物溶于含酚酞的水,溶液显红色 | |
| C. | 简单离子半径:r(W)>r(M)>r(Y)>r(X) | |
| D. | 简单氢化物的稳定性:X>T>Y |
19.水溶液中能大量共存的一组离子是( )
| A. | NH4+、Ba2+、Br-、CO32- | B. | Cl-、SO32-、Fe2+、H+ | ||
| C. | K+、Na+、SO42-、MnO4- | D. | Na+、H+、NO3-、HCO3- |
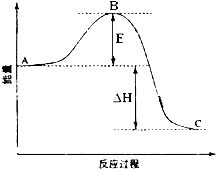 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题: