题目内容
16.硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如图: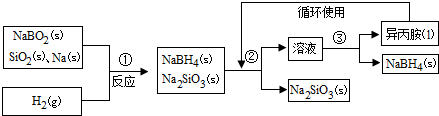
已知:NaBH4常温下能与水反应,可溶于异丙胺(沸点:33℃);
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是除去反应器中的水蒸气和空气,原料中的金属钠通常保存在煤油中,实验室取用少量金属钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀等;
(2)请配平第①步反应的化学方程式:
1NaBO2+2SiO2+4Na+2H2═1NaBH4+2Na2SiO3
(3)第②步分离采用的方法是过滤;第③步分出NaBH4并回收溶剂,采用的方法是蒸馏;
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g).在25℃、101kPa下,已知每消耗3.8gNaBH4(s)放热21.6kJ,该反应的热化学方程式是NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g)△H=-216.0kJ/mol.
分析 NaBO2、SiO2、Na和H2在一定条件下反应生成NaBH4、Na2SiO3,NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出;NaBH4可溶于异丙胺,根据③知,②中加入的溶剂是异丙胺,NaBH4溶解于异丙胺、Na2SiO3不溶于异丙胺,难溶性固体和溶液采用过滤方法分离,通过过量得到滤液和滤渣,滤渣成分是Na2SiO3;异丙胺沸点:33℃,将滤液采用蒸馏的方法分离,得到异丙胺和固体NaBH4,
(1)为防止安全事故发生和防止NaBH4水解,在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,从而排出空气和水蒸气;
原料中的金属钠通常保存在煤油中,需要用到的实验用品有镊子、滤纸、玻璃片和小刀等;
(2)该反应中H元素化合价由0价变为-1价、Na元素化合价由0价变为+1价,根据转移电子守恒、原子守恒配平方程式;
(3)分离难溶性固体和溶液采用过滤方法;熔沸点相差较大的可以采用蒸馏方法;
(4)n(NaBH4)=$\frac{3.8g}{38g/mol}$=0.1mol,在25℃、101kPa下,每消耗0.1molNaBH4(s)放热21.6kJ,则消耗1molNaBH4(s)放热216.0kJ,据此书写热化学方程式.
解答 解:NaBO2、SiO2、Na和H2在一定条件下反应生成NaBH4、Na2SiO3,NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出;NaBH4可溶于异丙胺,根据③知,②中加入的溶剂是异丙胺,NaBH4溶解与异丙胺、Na2SiO3不溶于异丙胺,难溶性固体和溶液采用过滤方法分离,通过过量得到滤液和滤渣,滤渣成分是Na2SiO3;异丙胺沸点:33℃,将滤液采用蒸馏的方法分离,得到异丙胺和固体NaBH4,
(1)NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出;
钠极易和空气中氧气、和水反应,钠的密度大于煤油,为隔绝空气和水,原料中的金属钠通常保存在煤油中;
实验室取用少量金属钠时,需要镊子夹取钠、用滤纸吸煤油,所以实验室取用少量金属钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀等,
故答案为:除去反应器中的水蒸气和空气;煤油;镊子、滤纸;
(2)该反应中H元素化合价由0价变为-1价、Na元素化合价由0价变为+1价,转移电子总数为4,
根据转移电子守恒、原子守恒配平方程式为NaBO2+2SiO2+4Na+2H2═NaBH4+2Na2SiO3,
故答案为:1;2;4;2;1;2;
(3)分离难溶性固体和溶液采用过滤方法,②中加入的溶剂是异丙胺,NaBH4溶解与异丙胺、Na2SiO3不溶于异丙胺,所以第②步分离采用的方法是过滤;熔沸点相差较大的可以采用蒸馏方法,异丙胺沸点:33℃,将滤液采用蒸馏的方法分离,得到异丙胺和固体NaBH4,
故答案为:过滤;蒸馏;
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),n(NaBH4)=$\frac{3.8g}{38g/mol}$=0.1mol,在25℃、101kPa下,每消耗0.1molNaBH4(s)放热21.6kJ,则消耗1molNaBH4(s)放热216.0kJ,则热化学方程式为NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g)△H=-216.0kJ/mol,
故答案为:NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g)△H=-216.0kJ/mol.
点评 本题考查物质制备实验方案设计,为高频考点,侧重考查学生分析推断及知识综合应用能力,涉及物质分离提纯、热化学反应方程式的书写、氧化还原反应、实验基本操作等知识点,综合性较强且较基础,难点是分析流程图中发生的反应、基本操作等,题目难度中等.

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案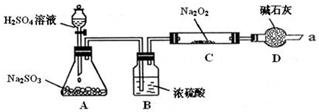
写出装置A中发生反应的化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以吸收尾气在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;假设2:只有Na2SO4;假设3:既有Na2SO3,又有Na2SO4.
(1)若假设1成立,写出SO2与Na2O2反应的化学方程式:2Na2O2+2SO2=2Na2SO3+O2↑.
(2)为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:

甲同学由此得出结论:产物是Na2SO4,该方案是否合理否否(填“是”或“否”),理由是硝酸有强氧化性,硝酸可以将BaSO3沉淀氧化为BaSO4
(3)乙同学设计了如下实验验证假设3成立,请帮助他完成下表.
| 实验步骤 | 现象 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解. | 固体全部溶解 |
| ②向上试管中加入过量的稀盐酸,将产生的气体通入少量酸性KMnO4溶液中. | KMnO4溶液紫色褪去 |
| ③向步骤②反应后的试管中,加入适量的BaCl2溶液. | 产生白色沉淀 |
| A. | 已知A-+H2B(过量)═HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| C. | 浓度为0.1mol•L-1 的下列溶液,pH由大到小的排列顺序:NaOH>Na2CO3 >(NH4)2SO4 >NaHSO4 | |
| D. | 为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸,若pH<7,则H2A是强酸 |
| A. | 苯 | B. | 四氯化碳 | C. | 乙烯 | D. | 乙炔 |
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+个数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
| A. | 淀粉和蛋白质水解的最终产物都只有一种 | |
| B. | 蔗糖和淀粉都不能发生氧化反应 | |
| C. | 棉花、合成纤维、ABS树脂、蚕丝和核酸都属于高分子化合物 | |
| D. | 石油裂解和油脂皂化都是由高分子生成小分子的过程 |
| A. | 甲烷 | B. | 乙烯 | C. | 乙炔 | D. | 苯 |
| A. | 中性溶液的 AG=0 | B. | 酸性溶液的AG<0 | ||
| C. | 常温下0.1mol/LNaOH溶液的AG=12 | D. | 常温下0.1mol/L盐酸溶液的AG=12 |
 A、B、C、D、E原子序数依次增大,且为前四周期的元素,其中B2-和C+具有相同的核外电子排布;D的氢化物的沸点比其上一周期同族元素氢化物的沸点低;E核外有五个单电子,B、E形成的某种化合物和A、D形成的化合物的浓溶液加热时反应可用于实验时制取气态单质D.
A、B、C、D、E原子序数依次增大,且为前四周期的元素,其中B2-和C+具有相同的核外电子排布;D的氢化物的沸点比其上一周期同族元素氢化物的沸点低;E核外有五个单电子,B、E形成的某种化合物和A、D形成的化合物的浓溶液加热时反应可用于实验时制取气态单质D.