题目内容
19.X,Y,Z,W是原子序数依次增大的短周期元素,且原子最外层电子数之和为16.X与其他元素即不再同一周期,也不再同一主族.Y的阴离子与Z的阳离子具有相同的电子结构层,W原子得到一个电子后可形成与稀有气体原子相同的电子层结构.下列说法合理的是( )| A. | 简单离子半径:W>Y>Z | |
| B. | X与Y可形成既含极性键又含非极性键的化合物 | |
| C. | Z与W形成的化合物一定是离子化合物 | |
| D. | Y的氧化物对应的水化物的酸性一定比W的弱 |
分析 X、Y、Z、W是原子序数依次增大的短周期元素,Y的阴离子与Z的阳离子具有相同的电子层结构,结合原子序数可知,Y不能是H元素,故Y处于第二周期、Z处于第三周期,X与其它元素不在同一周期和同一主族,故X为H元素;W原子得到一个电子后可形成与稀有气体原子相同的电子层结构,结合原子序数可知,W处于第三周期ⅦA族,故W为Cl元素;4种元素的原子最外层电子数之和为16,则Y、Z的最外层电子数之和=16-1-7=8,结合题目信息,若Z为Mg、则Y为O,若Z为Al、则Y为N,据此解答.
解答 解:X、Y、Z、W是原子序数依次增大的短周期元素,Y的阴离子与Z的阳离子具有相同的电子层结构,结合原子序数可知,Y不能是H元素,故Y处于第二周期、Z处于第三周期,X与其它元素不在同一周期和同一主族,故X为H元素;W原子得到一个电子后可形成与稀有气体原子相同的电子层结构,结合原子序数可知,W处于第三周期ⅦA族,故W为Cl元素;4种元素的原子最外层电子数之和为16,则Y、Z的最外层电子数之和=16-1-7=8,结合题目信息,若Z为Mg、则Y为O,若Z为Al、则Y为N.
A.Y、Z离子电子层结构相同,Z的核电荷数较大,Z离子半径较小,W离子电子层最多,离子半径最大,故离子半径:W>Y>Z,故A正确;
B.Y为O或N,H与Y形成的化合物中,既含极性键又含非极性键的物质有H2O2、N2H4等,故B正确;
C.若Z为Mg,与Cl元素形成的化合物为氯化镁,属于离子化合物,若Z为Al,与Cl元素形成的化合物为氯化铝,属于共价化合物,故C错误;
D.若Y为O元素,不存在最高价氧化物对应的水化物,若Y为N元素,可以形成硝酸,硝酸的酸性比HClO的酸性强,故D错误;
故选AB.
点评 本题考查结构性质位置关系应用,推断元素是解题的关键,对学生的逻辑推理有一定的要求,注意Y、Z元素的不确定性,难度中等.

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | 40% | B. | 60% | C. | 30% | D. | 50% |
| A. | 已知A-+H2B(过量)═HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| C. | 浓度为0.1mol•L-1 的下列溶液,pH由大到小的排列顺序:NaOH>Na2CO3 >(NH4)2SO4 >NaHSO4 | |
| D. | 为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸,若pH<7,则H2A是强酸 |
| A. | 苯 | B. | 四氯化碳 | C. | 乙烯 | D. | 乙炔 |
| A. | 淀粉和蛋白质水解的最终产物都只有一种 | |
| B. | 蔗糖和淀粉都不能发生氧化反应 | |
| C. | 棉花、合成纤维、ABS树脂、蚕丝和核酸都属于高分子化合物 | |
| D. | 石油裂解和油脂皂化都是由高分子生成小分子的过程 |
| A. | 氯气、SO2都能使品红溶液褪色,它们的漂白原理相同 | |
| B. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、I-可能大量共存 | |
| C. | 某溶液中加入盐酸酸化的氯化钡产生白色沉淀,原溶液中一定含有SO42- | |
| D. | Fe(NO3)2溶液中滴加少量稀硫酸会变黄色 |
 (C)
(C) (D)
(D)
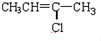 (G)
(G)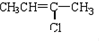 (H)
(H)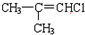
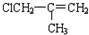 (J)
(J)
 A、B、C、D、E原子序数依次增大,且为前四周期的元素,其中B2-和C+具有相同的核外电子排布;D的氢化物的沸点比其上一周期同族元素氢化物的沸点低;E核外有五个单电子,B、E形成的某种化合物和A、D形成的化合物的浓溶液加热时反应可用于实验时制取气态单质D.
A、B、C、D、E原子序数依次增大,且为前四周期的元素,其中B2-和C+具有相同的核外电子排布;D的氢化物的沸点比其上一周期同族元素氢化物的沸点低;E核外有五个单电子,B、E形成的某种化合物和A、D形成的化合物的浓溶液加热时反应可用于实验时制取气态单质D.