题目内容
【题目】根据下图所得判断正确的是( )
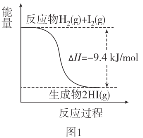
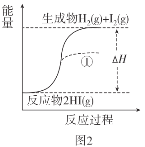
已知:I2(g)=I2(s) ΔH=-62.4kJ/mol
A.图1反应为吸热反应
B.图2反应的热化学方程式为2HI(g)![]() H2(g)+I2(g) ΔH=+9.4kJ/mol
H2(g)+I2(g) ΔH=+9.4kJ/mol
C.图2中若I2的状态为固态,则能量变化曲线可能为①
D.断裂1molH2(g)和1molI2(g)中化学键需要的能量大于断裂2molHI(g)中化学键需要的能量
【答案】B
【解析】
A.图1中,反应物的总能量高于生成物的总能量,是放热反应,A错误;
B.根据图1,可知H2(g)+I2(g)![]() 2HI(g) ΔH=-9.4kJ·mol-1,根据盖斯定律,可知2HI(g)
2HI(g) ΔH=-9.4kJ·mol-1,根据盖斯定律,可知2HI(g)![]() H2(g)+I2(g) ΔH=+9.4kJ·mol-1,B正确;
H2(g)+I2(g) ΔH=+9.4kJ·mol-1,B正确;
C.根据已知I2(g)=I2(s) ΔH=-62.4kJ/mol,以及H2(g)+I2(g)![]() 2HI(g) ΔH=-9.4kJ·mol-1,可知2HI(g)
2HI(g) ΔH=-9.4kJ·mol-1,可知2HI(g)![]() H2(g)+I2(s) ΔH=-53.0 kJ/mol。曲线①表示是吸热反应,而HI(g)分解生成H2(g)和I2(s)是放热反应,C错误;
H2(g)+I2(s) ΔH=-53.0 kJ/mol。曲线①表示是吸热反应,而HI(g)分解生成H2(g)和I2(s)是放热反应,C错误;
D.根据△H=反应物的总键能-生成物的总键能。根据图1,H2(g)和I2(g)反应生成HI(g)是放热反应,△H<0,可知断裂1molH2(g)和1molI2(g)中化学键需要的能量小于断裂2molHI(g)中化学键需要的能量,D错误;
答案选B。

【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 将某有机物与溴的四氯化碳溶液混合 | 溶液褪色 | 该有机物中必定含有碳碳双键 |
B | 向亚硫酸钠溶液中滴加硝酸钡和稀硝酸 | 产生白色沉淀 | 亚硫酸钠溶液已变质 |
C | 向酸性高锰酸钾溶液中滴加双氧水 | 紫色褪去,产生气泡 | H2O2具有还原性 |
D | 向乙醇溶液中加一小块钠 | 产生气泡 | 乙醇含有羟基 |
A.AB.BC.CD.D
【题目】下列操作对应的现象和离子方程式均正确的是( )
操作 | 现象 | 离子方程式 | |
A | 饱和碳酸钠溶液中通入过量CO2 | 无明显变化 | CO |
B | 向苏打溶液溶液中滴加稀硫酸 | 立即产生气泡 | CO |
C | 向Ba(OH)2溶液中加足量NaHCO3溶液 | 生成白色沉淀 | 2HCO |
D | 向NaHCO3溶液中加入少量偏铝酸钠 | 生成白色沉淀和无色气体 | HCO |
A.AB.BC.CD.D