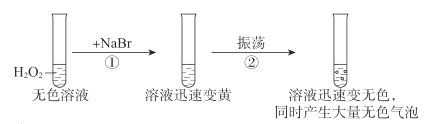
题目内容
【题目】锌铜原电池裝置如图所示,下列说法不正确的是( )

A.锌电极上发生反应:Zn-2e-=Zn2+
B.电子从锌片流向铜片
C.盐桥中K+移向ZnSO4溶液
D.理论上,当6.5gZn溶解时析出6.4gCu
【答案】C
【解析】
由装置可知该原电池的反应原理为:![]() ,锌作负极,铜作正极,
,锌作负极,铜作正极,
A.锌作负极,失电子,电极反应为:Zn-2e-=Zn2+,故A正确;
B.原电池中电子从负极(锌片)流出,经导线流向正极(铜片),故B正确;
C.原电池电解质溶液中阳离子向正极移动,阴离子向负极移动,因此盐桥中钾离子向硫酸铜溶液移动,故C错误;
D.由上述总反应可知,1molZn溶解产生1molCu,6.5gZn为0.1mol,产生Cu0.1mol,质量为6.4g,故D正确;
故选:C。

【题目】钴酸锂(LiCoO2)可用作锂离子电池的电极材料。以红土镍矿为原料制备LiCoO2的工艺流程如图:

已知:①红土镍矿的主要成分有Fe2O3、FeO、SiO2、Al2O3、CoO、NiO等。
②20℃时,生成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Ni2+ | Co2+ |
开始沉淀 | 7.0 | 1.9 | 3.4 | 7.2 | 7.1 |
沉淀完全 | 9.0 | 3.2 | 4.7 | 9.2 | 9.1 |
注:金属离子起始浓度为0.1mol/L
(1)上述流程中能加快反应速率的措施有__。
(2)H2O2的作用是将Fe2+氧化为Fe3+。
①加入H2O2发生反应的离子方程式是__。
②滤渣2的主要成分是__(写化学式)。
(3)萃取剂RH可用于对溶液中的Ni2+、Co2+进行分离与富集:Co2+(水相)+2RH(有机相)![]() CoR2(有机相)+2H+(水相)
CoR2(有机相)+2H+(水相)
①萃取剂浓度对溶液中Ni2+、Co2+的萃取率影响如图所示,萃取剂浓度的最佳取值为__mol/L。
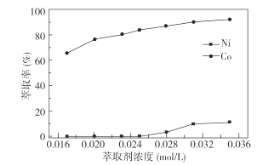
②在__(填“强碱性”或“强酸性”)介质中反萃取,使萃取剂再生而循环利用。
(4)向反萃取后的水溶液中加入稍过量NH4HCO3,得到CoCO3沉淀。将CoCO3与Li2CO3按n(Li):n(Co)=1的比例混合,鼓入空气,高温烧结,得到Li2CoO2。
①得到CoCO3沉淀的离子方程式是__。
②若使用(NH4)2CO3做沉淀剂,产物中会混有Co2(OH)2CO3,这是因为__。
③在空气中烧结反应的化学方程式是__。
【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用作木材的防腐剂等。用氧化锌烟尘(主要成分为ZnO,还含有少量PbO、CuO、Fe2 O3、FeO等)生产ZnSO4·7H2O的流程如下:

有关金属离子[c(Mn+)= 0.l mol/L]形成氢氧化物沉淀的pH范围如下表:
金属离 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 4.7 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 6.7 |
(1)“酸浸”时用的稀酸是____;滤渣1主要成分是____。
(2)“氧化”时的离子方程式为_________;加入ZnO除杂时溶液的pH控制范围是____~5.0。
(3)滤渣3含有锌和____;滤液得到ZnSO4·7H2O的操作是____、洗涤、干燥。
(4)取14.35gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 8. 95 | 8. 05 | 6. 72 | 4.05 |
则680℃时剩余固体的化学式为________(填序号)。
A.ZnO B.Zn3O(SO4