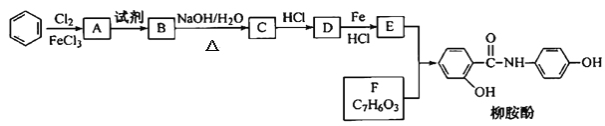
题目内容
【题目】可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为H3PO4,沸点高难挥发)有一定关系。
(1)室温下,测得0.1mol/LH3PO4溶液的pH=1.5,用电离方程式解释原因:__。
(2)长期过量饮用可乐会破坏牙釉质,使下面的平衡向脱矿方向移动,造成龋齿。结合平衡移动原理解释原因:__。
Ca5(PO4)3OH(s)![]() 5Ca2+(aq) +3PO
5Ca2+(aq) +3PO![]() (aq)+OH-(aq)
(aq)+OH-(aq)
(3)向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图所示。
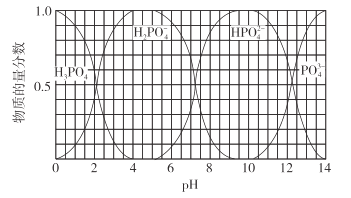
①向磷酸溶液中滴加NaOH溶液至pH=10时发生的主要反应的离子方程式是___。
②下列关于0.1mol/LNa2HPO4溶液的说法正确的是__(填序号)。
a.Na2HPO4溶液显碱性,原因是HPO![]() 的水解程度大于其电离程度
的水解程度大于其电离程度
b.c(Na+)+c(H+)=c(H2PO![]() )+2c(HPO
)+2c(HPO![]() )+3c(PO
)+3c(PO![]() )+c(OH-)
)+c(OH-)
c.c(Na+)=c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )+c(H3PO4)
)+c(H3PO4)
(4)小组同学在实验室测定某可乐中磷酸的含量(不考虑白砂糖、咖啡因的影响)。
i.将一瓶可乐注入圆底烧瓶,加入活性炭,吸附色素。
ⅱ.将可乐回流加热10min,冷却至室温,过滤。
ⅲ.取50.00mL滤液,用百里香酚酞作指示剂,用0.100mol/LNaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液5.00mL。
①加热的目的是__。
②该可乐样品中磷酸的含量为__g/L(H3PO4摩尔质量为98g/mol)。
【答案】H3PO4![]() H++H2PO
H++H2PO![]() 可乐为酸性饮料,长期过量饮用,可乐中的酸性物质中和OH-,c(OH-)减小,Ca5(PO4)3OH(s)
可乐为酸性饮料,长期过量饮用,可乐中的酸性物质中和OH-,c(OH-)减小,Ca5(PO4)3OH(s)![]() 5Ca2+(aq)+3PO
5Ca2+(aq)+3PO![]() (aq)+OH-(aq)平衡向脱矿方向移动,造成龋齿 为H3PO4+2OH-=HPO42-+2H2O ab 将可乐中的CO2气体赶出,防止干扰磷酸的测定 0.49
(aq)+OH-(aq)平衡向脱矿方向移动,造成龋齿 为H3PO4+2OH-=HPO42-+2H2O ab 将可乐中的CO2气体赶出,防止干扰磷酸的测定 0.49
【解析】
(1)如果H3PO4是强酸,0.1mol·L-1H3PO4溶液的pH<1,现0.1mol·L-1H3PO4溶液大于1,说明H3PO4是弱酸,部分电离,电离方程式为H3PO4![]() H++H2PO4-;
H++H2PO4-;
(2)可乐是酸性饮料,长期过量饮用,可乐中的酸性物质中和了OH-,c(OH-)减小,使Ca5(PO4)3OH(s)![]() 5Ca2+(aq)+3PO43-(aq)+OH-(aq)平衡向脱矿方向移动,造成龋齿;
5Ca2+(aq)+3PO43-(aq)+OH-(aq)平衡向脱矿方向移动,造成龋齿;
(3)①向磷酸溶液中滴加NaOH溶液至pH=10,溶液中含磷的主要微粒,从H3PO4转变为HPO42-,因此主要的离子方程式为H3PO4+2OH-=HPO42-+2H2O;
②a.Na2HPO4溶液中HPO42-既能电离又能水解,电离方程式和水解方程式分别为HPO42-![]() H++PO43-,HPO42-+H2O
H++PO43-,HPO42-+H2O![]() H3PO4+OH-;HPO42-的电离平衡常数
H3PO4+OH-;HPO42-的电离平衡常数![]() ,当c(PO43-)=c(HPO42-)时,溶液中的pH约为12.3,c(H+)=10-12.3mol·L-1,则
,当c(PO43-)=c(HPO42-)时,溶液中的pH约为12.3,c(H+)=10-12.3mol·L-1,则![]() ;HPO42-的水解平衡常数
;HPO42-的水解平衡常数![]() ,当c(H2PO4-)=c(HPO42-)时,溶液中的pH约为7.2,c(H+)=10-7.2mol·L-1,则
,当c(H2PO4-)=c(HPO42-)时,溶液中的pH约为7.2,c(H+)=10-7.2mol·L-1,则![]() ;可知HPO42-的水解程度大于其电离程度,溶液呈碱性,a正确;
;可知HPO42-的水解程度大于其电离程度,溶液呈碱性,a正确;
b.Na2HPO4溶液呈电中性,根据电荷守恒,有c(Na+)+c(H+)=
c.Na2HPO4溶液中,根据物料守恒,有c(Na+)=2[c(H2PO4-)+c(HPO42-)+c(PO43-)+ c(H3PO4)],c错误;
ab符合题意;
(4)①可乐溶液中,含有碳酸,也会与NaOH反应,会影响H3PO4的测定,因此加热的目的是将可乐中的CO2气体赶出,防止干扰磷酸的测定;
②滴定至终点时生成Na2HPO4,则关系式为H3PO4~2NaOH,则50mL可乐中含有![]() ;则该可乐样品中磷酸的含量=
;则该可乐样品中磷酸的含量=![]() 。
。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】常温下,有关物质的溶度积如下,下列有关说法不正确的是( )
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.60×10-12 | 2.80×10-39 |
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.0×10-21
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.0×10-2mol/L],若保持温度不变,向其中加入100mL0.012mol/L的NaOH,则该溶液变为不饱和溶液