题目内容
【题目】近年来,随着聚酯工业的快速发展,将氯化氢转化为氯气的技术成为科学研究的热点。传统的Deacon直接氧化法,按下列催化过程进行:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
(1)写出上述反应的平衡常数表达式K=___。
(2)生产过程中可使用CuCl2作催化剂,反应原理如下:
CuCl2(s)+![]() O2(g)=CuO(s)+Cl2(g) △H1=+63kJmol-1
O2(g)=CuO(s)+Cl2(g) △H1=+63kJmol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) △H2=-121kJmol-1
则4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的△H=___kJmol-1。
(3)生产中反应温度通常控制在420℃左右,原因是___。在一定温度下,进一步提高HCl平衡转化率的方法是___(写出2种)。
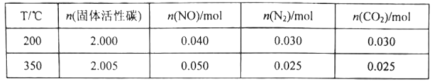
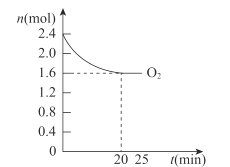
(4)420℃时,将一定量的O2和HCl通入4L的恒容密闭容器中,反应过程中氧气的变化量如图所示,则0~20min平均反应速率v(HCl)为___molL-1·min-1。
【答案】![]() -116 温度太低,反应速率太慢;温度太高,平衡逆向移动,产率降低 增加反应体系的压强、及时分离出产物 0.04
-116 温度太低,反应速率太慢;温度太高,平衡逆向移动,产率降低 增加反应体系的压强、及时分离出产物 0.04
【解析】
根据生成物浓度幂之积与反应物的浓度幂之积的比值表示化学平衡常数;利用盖斯定律计算焓变;从反应的能量变化和催化剂的角度分析,从化学平衡移动角度分析提高反应物转化率的方法;根据氧气的浓度变化量求出氧气的化学反应速率,根据化学反应速率之比等于化学计量数之比计算出氯化氢的化学反应速率。
(1)根据化学反应方程式4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)可知,化学平衡等于生成物浓度幂之积与反应物的浓度幂之积的比值,即反应的平衡常数表达式K=
2Cl2(g)+2H2O(g)可知,化学平衡等于生成物浓度幂之积与反应物的浓度幂之积的比值,即反应的平衡常数表达式K=![]() ;
;
(2)根据反应原理:①CuCl2(s)+![]() O2(g)=CuO(s)+Cl2(g)△H1=+63kJmol-1
O2(g)=CuO(s)+Cl2(g)△H1=+63kJmol-1
②CuO(s)+2HCl(g)=CuCl2(s)+H2O(g)△H2=-121kJmol-1
利用盖斯定律:2×(①+②)得到:4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的△H=-116kJmol-1;
(3)生产中反应温度通常控制在420℃左右,是因为温度太低,反应速率太慢;温度太高,平衡逆向移动,产率降低;
若想提高HCl的转化率,应该促使平衡向着正向移动,该反应为反应前后气体体积减小的反应,根据勒夏特列原理,可以增加反应体系压强,使平衡正向移动;也可以及时除去产物,减小产物浓度,使平衡正向移动;
(4)由图可知,0~20min平均反应速率v(O2)=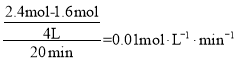 ,根据化学方程式:4HCl(g)+O2(g)2Cl2(g)+2H2O(g),v(HCl)=4v(O2)=0.04 molL-1·min-1。
,根据化学方程式:4HCl(g)+O2(g)2Cl2(g)+2H2O(g),v(HCl)=4v(O2)=0.04 molL-1·min-1。

 阅读快车系列答案
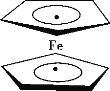
阅读快车系列答案【题目】按如图装置进行实验,下列推断正确的是( )
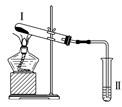
选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D