题目内容
11.对于任意一个化学平衡体系,采取下列措施,一定会使平衡发生移动的是( )| A. | 加入一种反应物 | B. | 增大体系的压强 | C. | 升高温度 | D. | 扩大容器体积 |
分析 A、在反应中,固体量的增减不会引起化学平衡的移动;
B、对于有气体参加的反应前后气体体积变化的反应,压强会引起平衡的移动;
C、升高温度,化学平衡向着吸热方向进行,任何化学反应一定伴随能量的变化;
D、使用催化剂只能改变化学反应的速率,不会引起化学平衡的移动.
解答 解:A、在反应中,加入一种固体反应物,固体量的增减不会引起化学平衡的移动,故A错误;
B、对于没有气体参加的反应,或是前后气体体积不变的反应,压强不会引起平衡的移动,故B错误;
C、任何化学反应一定伴随能量的变化,升高温度,化学平衡一定是向着吸热方向进行,故C正确;
D、对于没有气体参加的反应,或是前后气体体积不变的反应,扩大容器体积不会引起平衡的移动,故D错误.
故选C.
点评 本题考查学生影响化学平衡移动的因素,注意每个因素的使用情况是解答的关键,题目难度中等.

练习册系列答案
相关题目
1.8NH3+3Cl2═6NH4Cl+N2的反应中,若有8mol的NH3被氧化,则( )
| A. | 有3 molCl2被还原 | B. | 氧化产物为1mol | ||
| C. | 氧化产物为8mol | D. | 生成N2 4mol |
2.在一定条件下将含1molNH3的体积不变的密闭容器加热,发生反应2NH3?N2+3H2,一段时间后达到平衡,此时NH3的体积分数为x%.若在该容器中再加入1molNH3后密封,加热到相同温度,使反应达到平衡,设此时NH3的体积分数为y%,则x和y的关系正确的是( )
| A. | x<y | B. | x>y | C. | x=y | D. | x≧y |
19.一定温度下,可逆反应A(气)+3B(气)?2C(气)达到平衡的标志是( )
| A. | 单位时间生成n摩尔A,同时生成3n摩尔B | |
| B. | A,B,C的浓度不再变化 | |
| C. | A,B,C的分子数之比为1:3:2 | |
| D. | V正=V逆=0 |
6.下列说法正确的是( )
| A. | 书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可 | |
| B. | 凡是在加热或点燃条件下进行的反应都是吸热反应 | |
| C. | 把化学反应中物质的变化和反应的焓变同时表示出的化学方程式叫做热化学方程式 | |
| D. | 氢气在氧气中燃烧的热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ |
3.反应速率v和反应物浓度的关系是用实验方法测定的.化学反应H2+Cl2═2HCl的反应速率v可表示为v=k[H2]m[Cl2]n,式中k为常数,m、n值可用下表中数据确定.由此可推得,m、n值正确的是( )
| [H2]/mol•L-1 | [Cl2]/mol•L-1 | v/mol•L-1•s-1 |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
| A. | m=1、n=1 | B. | m=$\frac{1}{2}$、n=$\frac{1}{2}$ | C. | m=$\frac{1}{2}$、n=1 | D. | m=1、n=$\frac{1}{2}$ |
20.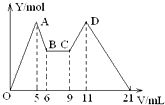 向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示.以下结论不正确的是( )
向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示.以下结论不正确的是( )
 向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示.以下结论不正确的是( )
向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示.以下结论不正确的是( )| A. | 从6到9,相应离子反应方程式为H++OH-=H2O | |
| B. | A 是NaOH,B是盐酸,且c(NaOH):c( HCl)=2:1 | |
| C. | 原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:1:5 | |
| D. | A是盐酸,B是NaOH,且c(NaOH)=2c (HCl) |
1.常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL某未知浓度的CH3COOH溶液,滴定曲线如图所示.已知在点③处恰好中和.下列说法错误的是( )
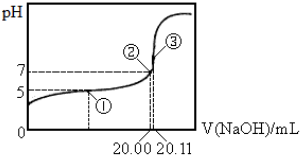

| A. | 该温度下CH3COOH的电离平衡常数约为1.8×10-5 | |
| B. | 点①处溶液中c(CH3COO-)<c(CH3COOH) | |
| C. | 点③处溶液中c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 滴定过程中不可能出现:c(CH3COOH)>c(CH3COO-)>c(OH-)>c(Na+)>c(H+) |