题目内容
10.把0.05mol NaOH固体分别加入到100mL下列液体中,溶液的导电能力变化最小的是( )| A. | 自来水 | B. | 0.5 mol•L-1盐酸 | ||
| C. | 0.5 mol•L-1 CH3COOH溶液 | D. | 0.5 mol•L-1 KCl溶液 |
分析 溶液导电能力与自由移动离子浓度成正比,溶液中导电能力变化最小,说明溶液中离子浓度变化最小,据此分析解答.
解答 解:A.自来水自由移动离子浓度较小,NaOH是强电解质,在水溶液中电离出自由移动阴阳离子而导致自来水中离子浓度变化较大,所以导电能力变化较大,故A不选;
B.盐酸和NaOH的物质的量相等,且HCl是强电解质,将NaOH固体加入稀盐酸中,二者恰好反应生成0.05mol/L的NaCl,NaCl是强电解质,所以溶液离子浓度变化不大,则溶液导电能力变化不大,故B选;
C.醋酸是弱电解质,在水溶液中部分电离,醋酸和氢氧化钠物质的量相等,且醋酸钠和醋酸浓度相等,二者反应生成强电解质醋酸钠,所以溶液中离子浓度变化较大,溶液导电能力变化较大,故C不选;
D.KCl、NaOH是强电解质,且NaOH和KCl不反应,加入NaOH后,溶液中离子浓度变化较大,则溶液导电能力变化较大,故D不选;
故选B.
点评 本题考查溶液导电能力,明确溶液导电能力与离子浓度关系是解本题关键,注意溶液导电能力与电解质强弱无关,与离子浓度有关,为易错点.

练习册系列答案
相关题目
20.已知:灰锡(以粉末状存在)和白锡是锡的两种同素异形体.Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)△H>0; 下列说法正确的是( )
| A. | 白锡比灰锡稳定 | |
| B. | 在常温下锡以灰锡状态存在 | |
| C. | 灰锡转化为白锡的反应是放热反应 | |
| D. | 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏 |
1.8NH3+3Cl2═6NH4Cl+N2的反应中,若有8mol的NH3被氧化,则( )
| A. | 有3 molCl2被还原 | B. | 氧化产物为1mol | ||
| C. | 氧化产物为8mol | D. | 生成N2 4mol |
5.下列电离方程式书写错误的是( )
| A. | NH3•H2O?NH4++OH- | B. | Ba(OH)2═Ba2++2OH- | ||
| C. | H2SO4═2H++SO42- | D. | NaHCO3═Na++H++CO32- |
15.下列关于电解池中形成的闭合回路的叙述中,正确的是( )
| A. | 电解池中的闭合回路仅是由电子的定向运动形成的 | |
| B. | 金属导线中,电子从电源的负极流向电解池的阳极,从电解池的阴极流向电源的正极 | |
| C. | 在电解质溶液中,阴离子向阴极运动,阳离子向阳极运动 | |
| D. | 相同时间内,阳离子在阴极上得到的电子与阴离子在阳极上失去的电子数相同 |
2.在一定条件下将含1molNH3的体积不变的密闭容器加热,发生反应2NH3?N2+3H2,一段时间后达到平衡,此时NH3的体积分数为x%.若在该容器中再加入1molNH3后密封,加热到相同温度,使反应达到平衡,设此时NH3的体积分数为y%,则x和y的关系正确的是( )
| A. | x<y | B. | x>y | C. | x=y | D. | x≧y |
19.一定温度下,可逆反应A(气)+3B(气)?2C(气)达到平衡的标志是( )
| A. | 单位时间生成n摩尔A,同时生成3n摩尔B | |
| B. | A,B,C的浓度不再变化 | |
| C. | A,B,C的分子数之比为1:3:2 | |
| D. | V正=V逆=0 |
20.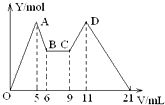 向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示.以下结论不正确的是( )
向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示.以下结论不正确的是( )
 向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示.以下结论不正确的是( )
向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示.以下结论不正确的是( )| A. | 从6到9,相应离子反应方程式为H++OH-=H2O | |
| B. | A 是NaOH,B是盐酸,且c(NaOH):c( HCl)=2:1 | |
| C. | 原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:1:5 | |
| D. | A是盐酸,B是NaOH,且c(NaOH)=2c (HCl) |