题目内容
【题目】CO2 的资源化利用能有效减少 CO2 排放,充分利用碳资源。
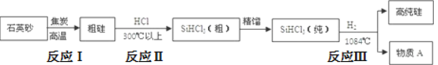
⑴在海洋碳循环中,通过如图所示的途径固碳。
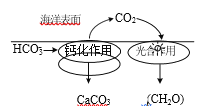
①写出钙化作用的离子方程式_____。
②同位素示踪法证实光合作用释放出的O2 只来自于H2O。用18O标记物质的光合作用的化学方程式如下,将其补充完整:
______________+________________![]()
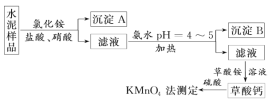
⑵电解法转化 CO2 可实现 CO2 资源化利用。电解 CO2 制 HCOOK 的原理示意图如下。
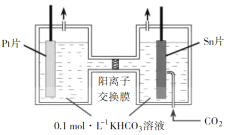
①阴极的电极反应式为_____。
②电解一段时间后,阳极区KHCO3 浓度下降,原因是______________________________________。
⑶CO2 催化加氢合成二甲醚是一种 CO2 转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g) + H2(g) === CO(g) + H2O(g) ΔH = +41.2 kJ·mol1
反应Ⅱ:2CO2(g) + 6H2(g) === CH3OCH3(g) + 3H2O(g) ΔH = 122.5 kJ·mol1
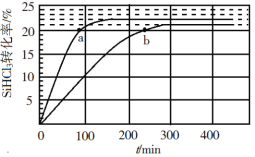
在恒压、CO2 和H2 的起始量一定的条件下,CO2 平衡转化率和平衡时 CH3OCH3 的选择性随温度的变化如图。
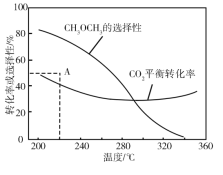
CH3OCH3 的选择性 =2CH3OCH3的物质的量反应的CO2的物质的量×100%
①温度高于300 ℃时,CO2 平衡转化率随温度升高而上升的原因是____________。
②220℃时,在催化剂作用下 CO2 与H2 反应一段时间后,测得 CH3OCH3 的选择性为48%(图中 A 点)。反应时间和温度不变,提高 CH3OCH3 选择性的措施有_________________。
A.增大压强 B. 使用对反应Ⅱ催化活性更高的催化剂 C. 及时移走产物
【答案】Ca2+ + 2HCO3- = CaCO3 ↓+ CO2↑+ H2O xCO2 2xH2O CO2 + 2e- + H2O =HCOO- + OH- 氢氧根与碳酸氢根反应生成碳酸根和水 反应Ⅰ是吸热反应,反应向吸热反应方向移动即正向移动,反应Ⅱ是放热反应,升高温度,平衡向吸热反应方向移动即逆向移动,升高温度,对反应Ⅱ的影响大于反应Ⅰ,因此CO2平衡转化率随温度升高而上升 ABC
【解析】
⑴①钙化作用是钙离子和碳酸氢根反应生成碳酸钙、二氧化碳和水;②根据质量守恒配平反应。
⑵①电解 CO2 制 HCOOK,化合价降低,在阴极反应;②分析阴极产物与碳酸氢根反应。
⑶①根据图中信息,温度高于300℃时,分析两个反应在改变温度时平衡移动谁占主要;②根据平衡移动原理及存在两个竞争的反应来分析提高CH3OCH3选择性的措施。
⑴①钙化作用是钙离子和碳酸氢根反应生成碳酸钙、二氧化碳和水,其离子方程式Ca2+ + 2HCO3- = CaCO3 ↓+ CO2↑+ H2O;故答案为:Ca2+ + 2HCO3- = CaCO3 ↓+ CO2↑+ H2O。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,根据质量守恒得到化学方程式xCO2 + 2xH2O![]() ;故答案为:xCO2 ;2xH2O。
;故答案为:xCO2 ;2xH2O。
⑵①电解 CO2 制 HCOOK,化合价降低,在阴极反应,因此阴极的电极反应式为CO2 + 2e- + H2O =HCOO- + OH-;故答案为:CO2 + 2e- + H2O =HCOO- + OH-。
②阴极生成氢氧根,氢氧根与碳酸氢根反应生成碳酸根和水,因此电解一段时间后,阳极区KHCO3 浓度下降;故答案为:氢氧根与碳酸氢根反应生成碳酸根和水。
⑶①根据图中信息,温度高于300℃时,CO2平衡转化率随温度升高而上升的原因是反应Ⅰ是吸热反应,反应向吸热反应方向移动即正向移动,反应Ⅱ是放热反应,升高温度,平衡向吸热反应方向移动即逆向移动,升高温度,对反应Ⅱ的影响大于反应Ⅰ,因此CO2平衡转化率随温度升高而上升;故答案为:反应Ⅰ是吸热反应,反应向吸热反应方向移动即正向移动,反应Ⅱ是放热反应,升高温度,平衡向吸热反应方向移动即逆向移动,升高温度,对反应Ⅱ的影响大于反应Ⅰ,因此CO2平衡转化率随温度升高而上升。
②A. 反应Ⅱ是体积减小的反应,而反应Ⅰ是等体积反应,增大压强,反应Ⅱ平衡正向移动,提高CH3OCH3选择性;B. 反应存在两个竞争的反应,因此使用对反应Ⅱ催化活性更高的催化剂来提高CH3OCH3选择性;C. 及时移走产物CH3OCH3,能使得反应Ⅱ不断正向反应,增加CH3OCH3选择性;综上所述,答案为ABC。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案