题目内容
【题目】25 ℃下,部分弱酸的电离常数如表。下列有关说法正确的是
弱酸 | HCOOH | HClO | H2S |
电离平衡 常数(Ka) | Ka=1.0×10-4 | Ka=2.0×10-8 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
A.相同浓度的HCOOH和HClO溶液的pH后者小
B.若HCOONa和HCOOH的混合溶液的pH=3,则![]() =10
=10
C.任何浓度NaHS溶液中总存在:c(Na+)+c(H+)=c(OH-)+c(HS-)
D.向NaClO溶液中通入H2S发生的反应为2ClO-+H2S===S2-+2HClO
【答案】B
【解析】
A、 由电离常数可知,HCOOH比HClO易电离,则等体积、等浓度的HCOOH和 HClO溶液中,HCOOH的电力程度更大,pH更小,故A错误;
B、在溶液中HCOOH的电离常数 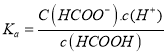 ,则pH=3的HCOONa和HCOOH的混合溶液中
,则pH=3的HCOONa和HCOOH的混合溶液中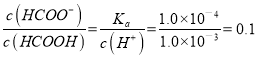 ,所以
,所以![]() =10,故B正确;
=10,故B正确;
C.、NaHS溶液中一定存在电荷守恒c( Na+) +c( H+) =c( OH-) +2c( S2-)+c( HS- ) ,故C错误;
D、向NaClO溶液中通入H2S,因NaClO具有强氧化性,与H2S在溶液中发生氧化还原反应,不是发生复分解反应,故D错误;
故选B。

练习册系列答案
相关题目