题目内容
【题目】下列各组物质中,中心原子的杂化类型相同的一组是( )
A. CO2和SO2B. NH3和BF3C. H2O和BeCl2D. CH4和CF4
【答案】D
【解析】
A.CO2中C形成2个σ键,无孤电子对,为sp杂化;SO2中S形成2个σ键,孤电子对数=![]() =1,为sp2杂化,杂化类型不相同,故A错误;
=1,为sp2杂化,杂化类型不相同,故A错误;
B.NH3中N原子杂化轨道数为3+![]() =4,采取sp3杂化;BF3中B原子杂化轨道数为3+
=4,采取sp3杂化;BF3中B原子杂化轨道数为3+![]() =3,采取sp2杂化,杂化类型不相同,故B错误;
=3,采取sp2杂化,杂化类型不相同,故B错误;
C.H2O中O形成2个σ键,孤电子对数=![]() =2,为sp3杂化;BeCl2中Be形成2个σ键,无孤电子对,为sp杂化,杂化类型不相同,故C错误;
=2,为sp3杂化;BeCl2中Be形成2个σ键,无孤电子对,为sp杂化,杂化类型不相同,故C错误;
D.CH4中C形成4个σ键,无孤电子对,为sp3杂化;CF4中C形成4个σ键,无孤电子对,为sp3杂化,杂化类型相同,故D正确;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作 | 现象 | 实验结论 | |
A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
C | 将纯Zn片与纯Cu片用导线连接,浸入到稀硫酸溶液中 | Cu片表面产生大量气泡 | 金属性:Zn>Cu |
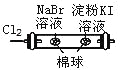
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
A. A B. B C. C D. D
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②Cr2O72-+H2O2CrO42-+2H+
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9)溶解 |
(1)实验室用18.4mol·L-1的浓硫酸配制480mL2mol·L-1的硫酸,配制时所用玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需_______。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_______。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为______(填微粒的化学式)。
(4)钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有_____。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:_____。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用0.1000mol·L-1AgNO3标准溶液滴定待测液,已知:

①滴定时可选为滴定指示剂的是_______(填编号),滴定终点的现象是_______。
A.NaCl B.K2CrO4 C.KI D.NaCN
②取某废水25.00ml,滴定终点时消耗AgNO3标准溶液10.00ml,则废水中SCN-的物质的量浓度为_______。