题目内容
【题目】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。
(1)工业合成氨反应:N2+3H2 ![]() 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量________(填“大于”、“小于”或“等于”)920kJ。
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量________(填“大于”、“小于”或“等于”)920kJ。
(2)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3
①则用N2表示的化学反应速率为__________________。
②一定条件下,当该反应进行到最大限度时,下列说法正确的是______(填编号)
a.N2的转化率达到最大值
b.N2、H2和NH3的体积分数之比为1 : 3 : 2
c.体系内气体的密度保持不变
d.体系内物质的平均相对分子质量保持不变
(3)某实验小组同学进行如下图所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度_______(填“升高”或“降低”)。反应过程____(填“①”或“②”)的能量变化可用图表示。

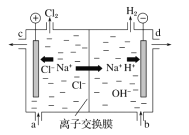
(4)用CH4和O2组合形成的质子交换膜燃料电池的结构如图:

①则d电极是____(填“正极” 或“负极”),c电极的电极反应式为_____________________________。
②若线路中转移2 mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为______L。
【答案】小于 0.25mol/(L·min) ad 降低 ① 正极 CH4-8e-+2H2O=CO2+8H+ 11.2
【解析】
(1)依据合成氨的反应是可逆反应作答;
(2)①根据![]() ,结合反应速率之比等于系数之比求算;
,结合反应速率之比等于系数之比求算;
②化学平衡状态是正逆反应速率相等,各组分浓度保持不变的状态,反应达到最大限度,据此分析;
(3)Al与盐酸反应放出热量,Ba(OH)28H2O与NH4Cl反应吸收热量,图2中反应物总能量大于生成物总能量,为放热反应;
(4)①依据原电池工作图中电子流出的方向判断正负极;
②根据电极反应式列出关系式计算氧气的消耗量;
(1)合成氨是可逆反应,反应物不能完全转化,所以将10 mol N2和足量H2混合,使其充分反应,放出的热量小于920kJ;
(2)①![]() ,又因为化学反应中,各物质表示的反应速率之比等于其系数之比,则v(N2)=
,又因为化学反应中,各物质表示的反应速率之比等于其系数之比,则v(N2)=![]() v(NH3)=
v(NH3)= ![]() ×0.5mol/(Lmin) = 0.25mol/(Lmin),
×0.5mol/(Lmin) = 0.25mol/(Lmin),
故答案为:0.25mol/(Lmin);
②a.N2的转化率达到最大值,则说明反应达到平衡状态,a项正确;
b. N2、H2和NH3的体积分数之比为1 : 3 : 2,不能说明各物质的浓度保持不变,无法说明反应达到平衡状态,b项错误;
c.体系内气体的总质量保持不变,总体积保持不变,则气体的密度始终保持不变,因此密度不变不能说明反应达到平衡状态,c项错误;
d. 因反应是气体分子数减小的体系,体系内气体的总质量保持不变,若物质的平均相对分子质量保持不变时,则气体的总物质的量保持不变,可说明反应达到平衡状态,d项正确;
故答案选ad;
(3)Ba(OH)28H2O与NH4Cl反应吸收热量,则反应后②中的温度降低;Al与盐酸反应放出热量,又从图中能量变化图可以看出,反应物的总能量高于生成物的总能量,则可表示反应①的能量变化;
(4)①因c是电子流出的一极,则c为负极,d为正极,甲烷具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CH4-8e-+2H2O=CO2+8H+,故答案为:正极;CH4-8e-+2H2O=CO2+8H+
②原电池中正极电极反应为2O2+8H++8e-=4H2O,当转移2mol电子时,则消耗氧气物质的量为0.5mol,体积为0.5mol×22.4L/mol=11.2 L。