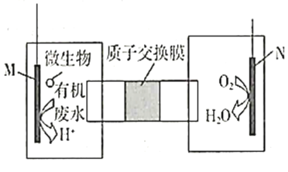
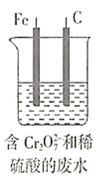
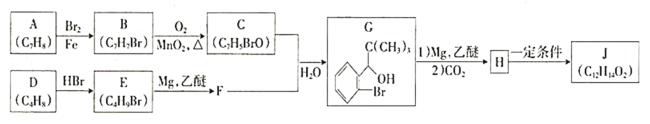
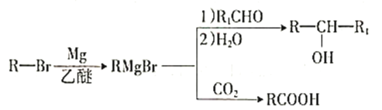
题目内容
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
①该反应能否自发进行与________________有关。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同)。
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2)表示的反应速率为__________。
②该反应的逆反应为________(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是____________________(用含a、b的数学式表示)。
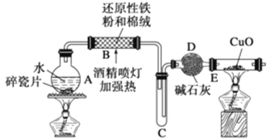
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
【答案】温度 bc 0.16mol/(L·min) 吸 b=2a,a>1(或使用合适的催化剂) cd
【解析】
(1)①利用判据:△H-T△S<0,得:与温度有关
②a、容积可变的密闭容器,则无论是否达平衡,压强不变,故a错误;
b、1mol H-H键断裂,表示v逆(H2),断裂2mol H-O键,表示v正(H2O),且两者相等,可以说明反应达到平衡,故b正确;
c、v正(CO)=v逆(H2O),可以说明反应达到平衡,c正确;
d、由于该反应涉及工业生产,根据方程式的化学计量系数可知:无论是否达平衡,c(CO)=c(H2),故d错误;
故选bc;
(2)① CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
系数 1 1 1 1
C0 2 1 0 0
△C 0.8 0.8 0.8 0.8
C(平衡)1.2 0.2 0.8 0.8
实验1中以v(CO2)= ![]() =
=![]() =0.16mol/(L·min);
=0.16mol/(L·min);
并计算,得:K(650℃) =![]() =2.67;
=2.67;
② CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
系数 1 1 1 1
C0 1 0.5 0 0
△C 0.2 0.2 0.2 0.2
C(平衡)0.8 0.3 0.2 0.2
同理:计算,得K(900℃) =![]() =0.17,说明升温,K值减小,平衡左移,则逆向为吸热的;
=0.17,说明升温,K值减小,平衡左移,则逆向为吸热的;
③等温、等容下的等效平衡(且压强不影响该平衡移动),即:a:b=1:2,t<3 min,即增大反应速率,所以a>1(或使用合适的催化剂);
(3)能使 c(CH3OH)增大,即平衡右移:
a、由图像知:正向为放热的,而升温,平衡左移,故a错误;
b、充入He(g),压强增大,该反应是气体体积不变的反应,平衡不移动,故b错误;
c、将H2O(g)从体系中分离出来,平衡右移,故c正确;
d、再充入1mol CO2和3mol H2,增大反应物浓度,平衡右移,故d正确;
故选cd。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案【题目】氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是![]() 和
和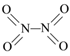 。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式_________________________
(2)对反应N2O4(g)![]() 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______
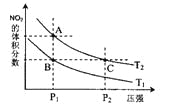
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____mol·(L·s)-1。
②n3____n4(填“>”、“<”或“=”),该反应的平衡常数K的值为_____________,升高温度后,反应2NO2![]() N2O4的平衡常数K将_______(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将_______(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)