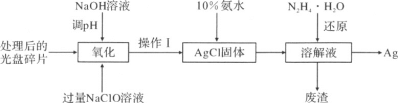
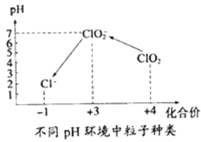
题目内容
【题目】把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.( ![]() -
-![]() ) mol/LB.(2b-a) mol/L
) mol/LB.(2b-a) mol/L
C.(5b-![]() ) mol/LD.(10b-5a) mol/L
) mol/LD.(10b-5a) mol/L
【答案】D
【解析】
500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,每份100 mL,设100 mL溶液中含有NH4HCO3 x mol,Na2CO3 y mol,NH4HCO3和Na2CO3的混合溶液加入NaOH,反应为NH4HCO3+2NaOH=NH3H2O+Na2CO3+H2O,则100 mL溶液中含NH4HCO3为0.5a mol,100 mL溶液中加入含b mol HCl的盐酸的反应为NH4HCO3+HCl=NH4Cl+CO2↑+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑,则其中Na2CO3的物质的量n(Na2CO3)=![]() ×(b-0.5a) mol,根据Na元素守恒可知溶液中含有Na+的物质的量n(Na+)=2n(Na2CO3)=(b-0.5a) mol,由于溶液的体积是100 mL,所以离子浓度c(Na+)=(b-0.5a) mol÷0.1 L=(10b-5a) mol/L;
×(b-0.5a) mol,根据Na元素守恒可知溶液中含有Na+的物质的量n(Na+)=2n(Na2CO3)=(b-0.5a) mol,由于溶液的体积是100 mL,所以离子浓度c(Na+)=(b-0.5a) mol÷0.1 L=(10b-5a) mol/L;
答案选D。

【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
①该反应能否自发进行与________________有关。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同)。
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2)表示的反应速率为__________。
②该反应的逆反应为________(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是____________________(用含a、b的数学式表示)。
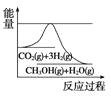
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
【题目】某同学研究FeSO4溶液和AgNO3溶液的反应,设计如下对比实验。
实验 |
Ⅰ |
Ⅱ |
现象 | 连通电路后,电流表指针向右偏转,分别取反应前和反应一段时间后甲烧杯中的溶液,滴加KSCN溶液,前者几乎无色,后者显红色 | 连通电路后,电流表指针向左发生微小的偏转,丙、丁烧杯中均无明显现象 |
下列说法正确的是
A.仅由Ⅰ中的现象可推知Ag+的氧化性强于Fe3+
B.Ⅱ中电流表指针向左偏转的原因是Fe2+氧化了银电极
C.Ⅱ中若将银电极换成石墨电极,电流表指针可能不再向左偏转
D.对比Ⅰ、Ⅱ可知,Ⅰ中NO3-氧化了Fe2+