题目内容
【题目】一种长效、缓释阿司匹林的合成路线如下图所示:
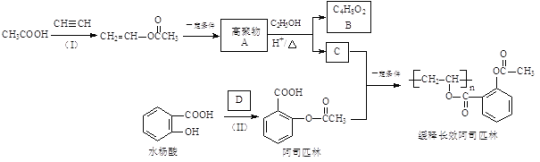
完成下列填空:
已知: RCOOR′+R"OH![]() RCOOR"+R′OH(R、R′、R"代表烃基)
RCOOR"+R′OH(R、R′、R"代表烃基)
(1)结构简式:A______________,B_______________;
(2)反应(Ⅰ)的反应类型为_________________,缓释长效阿司匹林结构中与“缓释作用”有关的官能团的名称为________________。
(3)D为乙酸酐,结构简式为![]() ,写出一种与D互为同分异构体且能发生银镜反应的酯类的结构简式:__________。
,写出一种与D互为同分异构体且能发生银镜反应的酯类的结构简式:__________。
(4)已知水杨酸酸性主要来源于“![]() ”,阿司匹林中将“
”,阿司匹林中将“![]() ”转化为“
”转化为“![]() ”能大大降低对肠胃的刺激,由此你可以得出的结论是_________。
”能大大降低对肠胃的刺激,由此你可以得出的结论是_________。
(5)已知:①乙炔与无机酸的反应和反应(Ⅰ)类似;②![]() ,现以乙炔、甲醇为原料,无机试剂任选,合成丙烯酸甲酯(
,现以乙炔、甲醇为原料,无机试剂任选,合成丙烯酸甲酯(![]() )_________。(合成路线常用的表示方式为:
)_________。(合成路线常用的表示方式为:![]() )
)
【答案】
![]() 加成 酯基
加成 酯基 ![]() 生成
生成![]() 可以降低阿司匹林的酸性
可以降低阿司匹林的酸性 ![]()
【解析】
由题中信息可知该反应过程为反应(I)为加成反应反应过程为![]() H+
H+![]()
![]() ,
,![]() 在一定条件下发生加聚反应,生成的加聚产物A结构为
在一定条件下发生加聚反应,生成的加聚产物A结构为 ,由题中信息RCOOR′+R"OH
,由题中信息RCOOR′+R"OH![]() RCOOR"+R′OH(R、R′、R"代表烃基)可知
RCOOR"+R′OH(R、R′、R"代表烃基)可知![]() 先反应生成
先反应生成![]() 和产物
和产物![]() (物质C),随后与阿司匹林酯化反应生成缓释长效阿司匹林。
(物质C),随后与阿司匹林酯化反应生成缓释长效阿司匹林。
(1)由分析可知A为![]() 的加聚反应的产物,故A的结构简式为
的加聚反应的产物,故A的结构简式为 ;
;
由已知RCOOR′+R"OH![]() RCOOR"+R′OH(R、R′、R"代表烃基)可知先发生取代反应生成
RCOOR"+R′OH(R、R′、R"代表烃基)可知先发生取代反应生成![]() ,
,![]() 与乙醇在酸性条件下加热发生酯化反应反应,故B为
与乙醇在酸性条件下加热发生酯化反应反应,故B为![]() ;
;
(2)由分析可知反应(Ⅰ)方程式为![]() H+
H+![]()
![]() ,所以该反应为加成反应,
,所以该反应为加成反应, 中官能团为酯键;
中官能团为酯键;
(![]() ;
;
(4)生成![]() 可以降低阿司匹林的酸性;
可以降低阿司匹林的酸性;

 小题狂做系列答案
小题狂做系列答案【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
①该反应能否自发进行与________________有关。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同)。
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2)表示的反应速率为__________。
②该反应的逆反应为________(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是____________________(用含a、b的数学式表示)。
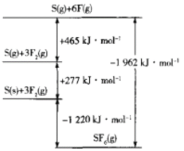
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
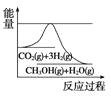
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
【题目】某同学研究FeSO4溶液和AgNO3溶液的反应,设计如下对比实验。
实验 |
Ⅰ |
Ⅱ |
现象 | 连通电路后,电流表指针向右偏转,分别取反应前和反应一段时间后甲烧杯中的溶液,滴加KSCN溶液,前者几乎无色,后者显红色 | 连通电路后,电流表指针向左发生微小的偏转,丙、丁烧杯中均无明显现象 |
下列说法正确的是
A.仅由Ⅰ中的现象可推知Ag+的氧化性强于Fe3+
B.Ⅱ中电流表指针向左偏转的原因是Fe2+氧化了银电极
C.Ⅱ中若将银电极换成石墨电极,电流表指针可能不再向左偏转
D.对比Ⅰ、Ⅱ可知,Ⅰ中NO3-氧化了Fe2+