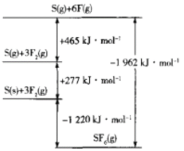
题目内容
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究。查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
I.摩擦剂中氢氧化铝的定性检验,取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量![]() 溶液,过滤。氢氧化铝与
溶液,过滤。氢氧化铝与![]() 溶液反应的离子方程式是___________
溶液反应的离子方程式是___________
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸,观察的现象是__________
Ⅱ.牙膏样品中碳酸钙的定量测定。利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的![]() 沉淀质量,以确定碳酸钙的质量分数。
沉淀质量,以确定碳酸钙的质量分数。
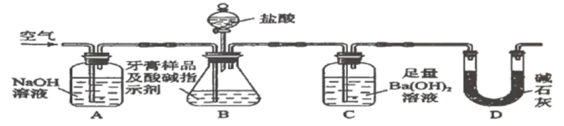
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:_____。
(4)C中反应生成沉淀的离子方程式是_______________。
(5)下列各项措施中,不能提高测定准确度的是________(填标号)。
a.在加入盐酸之前,应排净装置内的![]() 气体
气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取![]() 样品三份,进行三次测定,测得
样品三份,进行三次测定,测得![]() 平均质量为
平均质量为![]() 。则样品中碳酸钙的质量分数为_____________________。
。则样品中碳酸钙的质量分数为_____________________。
(7)有人认为不必测定C中生成的![]() 质量,只要测定装置C在吸收
质量,只要测定装置C在吸收![]() 前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是____________________。
前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是____________________。
【答案】![]() 通入CO2气体先没有现象后有白色沉淀生成,加入盐酸后先有气体产生,后有沉淀溶解; 在实验开始前先通空气,可排出装置内原空气中的CO2,实验结束后把B生成的CO2全部排入C中,使之完全被Ba(OH)2溶液吸收,减小误差
通入CO2气体先没有现象后有白色沉淀生成,加入盐酸后先有气体产生,后有沉淀溶解; 在实验开始前先通空气,可排出装置内原空气中的CO2,实验结束后把B生成的CO2全部排入C中,使之完全被Ba(OH)2溶液吸收,减小误差 ![]() cd 20.00% B中的水蒸气、氯化氢气体等进入装置C中,导致测定二氧化碳的质量偏大,测定的碳酸钙的质量偏大,碳酸钙的质量分数偏高
cd 20.00% B中的水蒸气、氯化氢气体等进入装置C中,导致测定二氧化碳的质量偏大,测定的碳酸钙的质量偏大,碳酸钙的质量分数偏高
【解析】
I.摩擦剂中氢氧化铝的定性检验主要围绕反应物的用量、固体或溶液中所含物质的性质回答;
Ⅱ.牙膏样品中碳酸钙的定量测定,实验原理是样品中的碳酸钙在过量HCl作用下转变成二氧化碳,二氧化碳再被过量氢氧化钡充分吸收得到碳酸钡沉淀,测定纯净而干燥的碳酸钡质量就可以计算出样品中碳酸钙的定量,据此回答;
Ⅰ.(1)氢氧化铝与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为:![]() ;
;
答案为:![]() ;
;
(2)滤液中含氢氧化钠和偏铝酸钠,先通入过量二氧化碳,氢氧化钠先与CO2发生反应,无明显现象,后![]() 出现沉淀,再加入过量稀盐酸, 溶液中的碳酸氢根离子先与氢离子反应
出现沉淀,再加入过量稀盐酸, 溶液中的碳酸氢根离子先与氢离子反应![]() ,放出气体,后发生
,放出气体,后发生![]() 反应,沉淀溶解;
反应,沉淀溶解;
答案为:先没有现象,而后有白色沉淀生成,加HCl先产生气泡,后沉淀全部溶解;
(3)未反应前装置内有空气,其中的二氧化碳会导致测定的碳酸钡的质量偏大,反应后装置中残留部分二氧化碳,不能被完全吸收,导致测定的碳酸钡的质量偏小;
答案为:在实验开始前先通空气,可排出装置内原空气中的CO2,实验结束后把B生成的CO2全部排入C中,使之完全被Ba(OH)2溶液吸收,减小误差;
(4):二氧化碳与氢氧化钡反应生成碳酸钡与水,离子方程式为:![]() ;
;
答案为:![]() ;
;
(5) a. 在加入盐酸之前,应排净装置内的CO2气体,防止影响碳酸钡质量的测定,可以提高测定准确度,故a错误;
b. 滴加盐酸过快CO2,CO2来不及被吸收,就排出装置C,滴加盐酸不宜过快,使二氧化碳吸收完全,可以提高测定准确度,故b错误;
c. 在AB之间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2,不能提高提高测定准确度,故c正确;
d. 在BC之间增添盛有饱和碳酸氢钠溶液的洗气装置,CO2中混有的HCl与碳酸氢钠反应生成二氧化碳,影响了CO2的总量,不能提高测定准确度,故d正确;
答案为:cd;
(6) BaCO3质量为3.94g,则n(BaCO3)=![]() =0.02mol,则n(CaCO3)=0.02mol,质量为0.02mol×100g/mol=2.00g,所以样品中碳酸钙的质量分数为:
=0.02mol,则n(CaCO3)=0.02mol,质量为0.02mol×100g/mol=2.00g,所以样品中碳酸钙的质量分数为:![]() ;
;
答案为:20.00%;
(7) 碳酸钙的质量分数偏高,是因为杂质气体进入装置C,使测得的二氧化碳的质量偏大,杂质气体来自B中的水蒸气、氯化氢气体;
答案为:B中的水蒸气、氯化氢气体等进入装置C中,导致测定二氧化碳的质量偏大,测定的碳酸钙的质量偏大,碳酸钙的质量分数偏高。

 阅读快车系列答案
阅读快车系列答案【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
①该反应能否自发进行与________________有关。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同)。
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2)表示的反应速率为__________。
②该反应的逆反应为________(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是____________________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
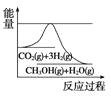
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2