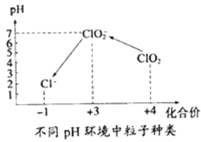
题目内容
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某研究小组拟设计微生物燃料电池将污水中的乙二胺![]() 氧化成环境友好的物质,再利用该装置模拟工业电解法来处理含
氧化成环境友好的物质,再利用该装置模拟工业电解法来处理含![]() 废水,电解过程溶液中发生反应为
废水,电解过程溶液中发生反应为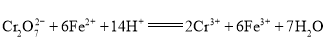 。当电池工作时,下列说法错误的是( )
。当电池工作时,下列说法错误的是( )
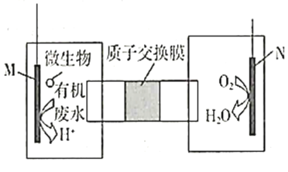
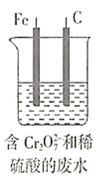
A.Fe棒应与N极相连
B.![]() 透过质子交换膜由右向左移动
透过质子交换膜由右向左移动
C.若溶液中减少了![]()
![]() ,则电路中至少转移
,则电路中至少转移![]() 电子
电子
D.M极电极反应式为H2N(CH2)2NH2+4H2O-16e-=2CO2↑+N2↑+16H+
【答案】B
【解析】
根据图示,燃料电池N极发生反应O2+4e-+4H+=2H2O,N发生还原反应,N是正极,M是负极,据此分析解答各选项。
A.电解过程溶液中发生反应为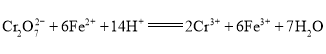 ,所以Fe棒失电子生成Fe2+,则Fe棒作阳极,应与N极相连,故A正确;
,所以Fe棒失电子生成Fe2+,则Fe棒作阳极,应与N极相连,故A正确;
B.原电池中阳离子移向正极,N是正极,M是负极,![]() 透过质子交换膜由左向右移动,故B错误;
透过质子交换膜由左向右移动,故B错误;
C.若溶液中减少了![]()
![]() ,则需要消耗0.6mol Fe2+,则电路中至少转移
,则需要消耗0.6mol Fe2+,则电路中至少转移![]() 电子,故C正确;
电子,故C正确;
D.M极是原电池负极,负极是乙二胺失电子生成二氧化碳、氮气,电极反应式为
H2N(CH2)2NH2+4H2O-16e-=2CO2↑+N2↑+16H+,故D正确;
答案选B。

【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
①该反应能否自发进行与________________有关。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同)。
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2)表示的反应速率为__________。
②该反应的逆反应为________(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是____________________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
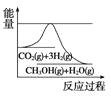
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2