题目内容
18.元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )| A. | 稀有气体元素 | |
| B. | 左、下方区域的金属元素 | |
| C. | 右、上方区域的非金属元素 | |
| D. | 金属元素和非金属元素分界线附近的元素 |
分析 用于制造半导体材料的元素既具有金属性又具有非金属性,以此来解答.
解答 解:A、稀有气体元素属于非金属元素,它们的性质稳定,一般不用来做半导体材料,故A错误;
B、左、下方区域的金属元素的金属性很强,不具有非金属性,故B错误;
C、右、上方区域的非金属元素的非金属性很强,不具有金属性,故C错误;
D、金属元素和非金属分界线附近的元素,既具有金属性又具有非金属性,则可用于制造半导体材料,故D正确;
故选D.
点评 本题考查元素的性质与元素在周期表中的位置,明确半导体材料具有的性质是解答本题的关键,难度不大.

练习册系列答案
相关题目
9.与氢氧根离子(OH-)具有相同的质子数和电子数的微粒是( )
| A. | CH4 | B. | NH4+ | C. | NH2- | D. | Cl- |
6.已知:2SO2+O2═2SO3为放热反应,对该反应的下列说法中正确的是( )
| A. | SO2的能量一定高于SO3的能量 | |
| B. | 因该反应为放热反应,故不必加热就可发生 | |
| C. | O2的能量一定高于SO2的能量 | |
| D. | SO2和O2的总能量一定高于SO3的总能量 |
13.下列图示与对应的叙述相符的是( )
| A. | 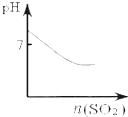 可表示将SO2气体通入氯水时pH的变化 | |
| B. |  表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液 | |
| C. | 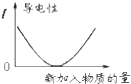 表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 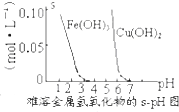 根据图,除去CuSO4溶液中Fe3+,可加氨水调节pH=4 |
10.能证明铝的金属性比镁弱的实验事实是( )
| A. | Al(OH)3能溶于NaOH溶液,而Mg(OH)2不能 | |
| B. | 铝的原子半径比镁小 | |
| C. | 镁与浓硫酸反应,铝与冷的浓硫酸不反应 | |
| D. | 铝的金属光泽不如镁显著 |
7.下列有关能量的判断和表示方法正确的是( )
| A. | 由C(s,石墨)→C(s,金刚石)-1.9 kJ,可知:石墨比金刚石更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 | |
| C. | 由H+(aq)+OH-(aq)→H2O(l)+57.3 kJ,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ | |
| D. | 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)→2H2O(l)+285.8 kJ |
8.反应NO2(g)+CO(g)=NO(g)+CO2(g)△H=+234kJ•mol-1的反应机理为:2NO2=NO3+NO(慢) NO2+CO=NO2+CO2(快)下列有关该反应的说法正确的是( )
| A. | 正反应的活化能比逆反应的活化能大234kJ•mol-1 | |
| B. | NO3是该反应的催化剂 | |
| C. | 化学反应速率v(NO2)=2v(CO) | |
| D. | 过程1和过程2均为放热反应 |
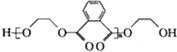 )的一种工业制法
)的一种工业制法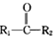 →浓盐酸Zn-HgR1-CH2-R2(其中R1、R2表示烃基或氢原子)
→浓盐酸Zn-HgR1-CH2-R2(其中R1、R2表示烃基或氢原子)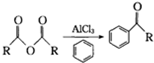 +RCOOH
+RCOOH
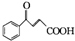 、G
、G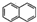 、H
、H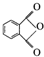 .
.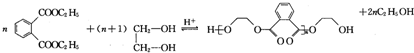 .
.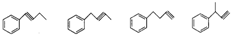 (其中一种).
(其中一种).