题目内容
【题目】25℃时,电离常数:
化学式 | CH3COOH | H2CO3 | HCN |
电离常数 | 1.8×10-5 | K1:4.3×10-7 K2:5.6×10-11 | 4.9×10-10 |
请回答下列问题:
(1)物质的量浓度为0.1mol·L-1的下列四种物质:
a.Na2CO3 b.NaCN c.CH3COONa d.NaHCO3
pH由大到小的顺序是____(填标号)。
(2)25℃时,在0.5mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的__倍。
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:______。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=___(填准确数值)。c(CH3COO-)/c(CH3COOH)=____。
(5)25℃时,将amol·L-1的醋酸与bmol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为____。
(6)某温度时,纯水的pH=6。该温度下0.01mol/LNaOH溶液的pH=___,向该温度下的纯水中加入少量的碳酸钠固体,使溶液pH为9,则水电离出的c(OH-)=____。
【答案】a>b>d>c 9×108 CN-+CO2+H2O=HCO3-+HCN 9.9×10-7mol·L-1(或10-6-10-8) 18 ![]() 10 10-3moL/L
10 10-3moL/L
【解析】
(1)酸越弱,对应酸根离子的水解程度越大,所以pH由大到小的顺序是a>b>d>c;
(2)Ka(CH3COOH)=![]() =
=![]() =1.8×10-5,c(CH3COOH)≈0.5mol·L-1,则c(H+)≈3×10-3mol·L-1,由水电离出的c(H+)约为
=1.8×10-5,c(CH3COOH)≈0.5mol·L-1,则c(H+)≈3×10-3mol·L-1,由水电离出的c(H+)约为![]() mol·L-1,故由醋酸电离出的c(H+)约是由水电离出的c(H+)的
mol·L-1,故由醋酸电离出的c(H+)约是由水电离出的c(H+)的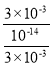 =9×108倍。
=9×108倍。
(3)酸性强弱顺序为H2CO3>HCN>HCO3-,所以向氰化钠溶液中通入少量二氧化碳的离子方程式为CN-+CO2+H2O=HCO3-+HCN。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合溶液pH=6,c(H+)=10-6mol·L-1,c(OH-)=10-8mol·L-1,则溶液中c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol·L-1-10-8 mol·L-1=9.9×10-7mol·L-1。通过电离平衡常数的表达式可知c(CH3COO-)/c(CH3COOH)=K(CH3COOH)/c(H+)=18;
(5)25℃时,将amol·L-1的醋酸与bmol·L-1氢氧化钠溶液等体积混合,反应后溶液恰好显中性,此时c(H+)=c(OH-)=10-7mol·L-1,c(CH3COO-)=c(Na+)=![]() mol·L-1,剩余的c(CH3COOH)=
mol·L-1,剩余的c(CH3COOH)=![]() mol·L-1,则Ka=
mol·L-1,则Ka=![]() =
=![]() 。
。
(6)纯水中的c(H+)=c(OH-),pH=6,c(H+)=c(OH-)=1×10-6molL-1,KW=1×10-6×1×10-6=1×10-12,0.01molL-1的NaOH溶液中氢氧根离子浓度为0.01mol/L,c(H+)=1×10-10molL-1,pH=-lgc(H+)=10;温度不变,水的离子积不变KW=1×10-12,pH=9的碳酸钠溶液中氢离子是由水电离产生的,水电离产生的c(H+)等于溶液中水电离出c(OH-),故水电离出c(OH-)=c(H+)=10-3mol/L。