题目内容
【题目】图中的A为直流电源,B为渗透饱和氯化钠溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色。请填空:
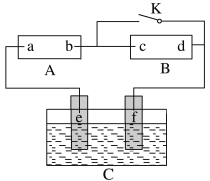
(1)电源A中a点为________极。
(2)滤纸B上发生氧化反应的电极反应方程式为:____________________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路:
①电极e上发生的反应为:__________________;
②在此过程中电解液的浓度(填“始终不变”、“略微增大”、“略微减小”)___________;
③电镀槽中盛放的电镀液可以是________或________(只要求填两种电解质溶液)。
【答案】正 2Cl--2e-= Cl2↑ Zn-2e-=Zn2+ 始终不变 硫酸锌溶液 氯化锌溶液
【解析】
(1)A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,说明c点有氢氧根离子生成,所以c是阴极、d是阳极,则a是正极、b是负极,e是阳极、f是阴极;
(2)滤纸B上,阴极上氢离子放电生成氢气、同时电极附近有氢氧根离子生成,阳极上氯离子放电生成氯气;
(3)电镀时,镀层金属作阳极、镀件作阴极,含镀层金属的阳离子作电解质溶液。
(1)A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,说明c点有氢氧根离子生成,因此c电极是阴极、d电极是阳极,则a是正极、b是负极;
(2)滤纸B上,阴极上H+离子放电生成H2、同时阴极附近有OH-离子生成,在阳极上Cl-离子放电生成Cl2,所以c点的电极反应式为:2H++2e-=H2,d点的电极反应式为:2Cl--2e-=Cl2;
(3)①电镀时,镀层金属作阳极,镀件作阴极,含镀层金属的阳离子作电解质溶液,所以若在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,由于a为正极,b为负极,则e为阳极Zn,锌失电子发生氧化反应,电解反应为Zn-2e-=Zn2+,f为阴极Fe,在阴极上锌离子得;
②电子发生还原反应,由于在反应过程中溶液中Zn2+物质的量不变,溶液的体积不变,所以在此过程中电解液的浓度始终不变;
③电解液可以为ZnSO4或ZnCl2或Zn(NO3)2等溶液。

【题目】25℃时,电离常数:
化学式 | CH3COOH | H2CO3 | HCN |
电离常数 | 1.8×10-5 | K1:4.3×10-7 K2:5.6×10-11 | 4.9×10-10 |
请回答下列问题:
(1)物质的量浓度为0.1mol·L-1的下列四种物质:
a.Na2CO3 b.NaCN c.CH3COONa d.NaHCO3
pH由大到小的顺序是____(填标号)。
(2)25℃时,在0.5mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的__倍。
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:______。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=___(填准确数值)。c(CH3COO-)/c(CH3COOH)=____。
(5)25℃时,将amol·L-1的醋酸与bmol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为____。
(6)某温度时,纯水的pH=6。该温度下0.01mol/LNaOH溶液的pH=___,向该温度下的纯水中加入少量的碳酸钠固体,使溶液pH为9,则水电离出的c(OH-)=____。