题目内容
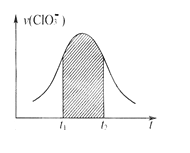
【题目】若在一定条件下,容积恒定的反应室中充入amolCO与2amolH2,在催化剂作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),下列措施一定使c(CH3OH)/c(CO)增大的是
CH3OH(g),下列措施一定使c(CH3OH)/c(CO)增大的是
A. 升高温度
B. 恒温恒容再充入a mol CO和2a mol H2
C. 恒温恒容再充入H2
D. 充入Ar(g)使体系的总压增大
【答案】BC
【解析】
A.由于没有告诉该反应是吸热反应还是放热反应,则无法判断升高温度后平衡移动方向,从而无法判断c(CH3OH)/c(CO)的比值大小,A错误;
B.恒温恒容再充入a mol CO和2a mol H2,相当于增大了压强,该反应是气体体积缩小的反应,所以平衡向着正向移动,导致甲醇浓度增大、CO的浓度减小,所以c(CH3OH)/c(CO)的比值增大,B正确;
C.恒温恒容再充入H2,反应物浓度增大,平衡向着正向移动,导致甲醇的浓度增大、CO的浓度减小,则c(CH3OH)/c(CO)的比值增大,C正确;
D.充入Ar(g),由于各组分的浓度不会发生变化,则化学平衡不发生移动,所以c(CH3OH)/c(CO)的比值不变,D错误;
答案选BC。
【点晴】
明确影响化学平衡的因素为解答关键,D为易错点,注意恒温恒容条件下充入稀有气体时,各组分浓度不变,平衡不移动。“惰性气体”对化学平衡的影响归纳如下:①恒温、恒容条件:原平衡体系![]() 体系总压强增大→体系中各组分的浓度不变→平衡不移动。②恒温、恒压条件:原平衡体系
体系总压强增大→体系中各组分的浓度不变→平衡不移动。②恒温、恒压条件:原平衡体系![]() 容器容积增大,各反应气体的分压减小→体系中各组分的浓度同倍数减小(等效于减压),平衡向气体体积增大的方向移动。
容器容积增大,各反应气体的分压减小→体系中各组分的浓度同倍数减小(等效于减压),平衡向气体体积增大的方向移动。

 阅读快车系列答案
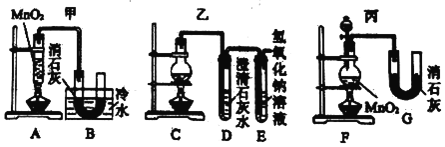
阅读快车系列答案【题目】腈亚胺与邻酚羟基苄醇在碱的作用下可以发生偶联反应生成醚键,反应的条件温和,操作简单,目标产物收率高。下面是利用该方法合成化合物H的一种方法:
注:以上合成路线中,Ph代表苯基,如PhNHNH2表示![]() 。
。
实验 | 碱 | 温度/℃ | 溶剂 | 产率% |
1 | Et3N | 25 | DCM | <10 |
2 | 吡啶 | 25 | DCM | <5 |
3 | Cs2CO3 | 25 | DCM | 70 |
4 | LiOtBu | 25 | DCM | 43 |
5 | Cs2CO3 | 25 | DMF | 79 |
6 | Cs2CO3 | 25 | CH3CN | 83 |
回答下列问题:
(1)A的化学名称为_________,B的结构简式为___________。
(2)由C生成D的反应类型是________,F中的官能团名称是___________。
(3)H的分子式为_______________。
(4)不同条件对偶联反应生成H产率的影响如上表:
观察上表可知,当选用DCM作溶剂时,最适宜的碱是____________,由实验3、实验4和实验5可得出的结论是:25℃时,____________________,H产率最高。
(5)X为G的同分异构体,写出满足下列条件的X的结构简式:____________。
①所含苯环个数与G相同;②有四种不同化学环境的氢,其个数比为1:1:2:2
(6)利用偶联反应,以![]() 和化合物D为原料制备
和化合物D为原料制备 ,
,
写出合成路线:____________________________。(其他试剂任选)
【题目】25℃时,电离常数:
化学式 | CH3COOH | H2CO3 | HCN |
电离常数 | 1.8×10-5 | K1:4.3×10-7 K2:5.6×10-11 | 4.9×10-10 |
请回答下列问题:
(1)物质的量浓度为0.1mol·L-1的下列四种物质:
a.Na2CO3 b.NaCN c.CH3COONa d.NaHCO3
pH由大到小的顺序是____(填标号)。
(2)25℃时,在0.5mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的__倍。
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:______。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=___(填准确数值)。c(CH3COO-)/c(CH3COOH)=____。
(5)25℃时,将amol·L-1的醋酸与bmol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为____。
(6)某温度时,纯水的pH=6。该温度下0.01mol/LNaOH溶液的pH=___,向该温度下的纯水中加入少量的碳酸钠固体,使溶液pH为9,则水电离出的c(OH-)=____。