题目内容
【题目】碱式次氯酸镁[Mg2ClO(OH)3·H2O]微溶于水,不吸湿,相对稳定,是一种有开发价值的无机抗菌剂。某研发小组通过下列流程制备碱式次氯酸镁:
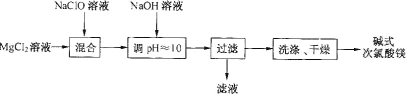
(1)从上述流程中可以判断,滤液中可回收的主要物质是__________。
(2)NaClO溶液用Cl2与NaOH溶液反应获得,写出该反应的化学方程式:_____。
(3)有效氯的含量是衡量次氯酸盐氧化能力的重要指标。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示:ClO-+Cl-+2H+=Cl2↑+H2O![]() ,若测得某碱式次氯酸镁产品中镁含量为29.01%,有效氯含量为40.28%。
,若测得某碱式次氯酸镁产品中镁含量为29.01%,有效氯含量为40.28%。
①通过计算判断该产品中镁和有效氯含量的测定值与理论值相比,是偏高或偏低?(写出计算过程)_____________
②根据你的判断,推测产品中可能含有的杂质,并给出制备过程能减少产品中含有该杂质的措施_____________
【答案】NaCl Cl2+2NaOH=NaCl+NaCl+H2O Mg2ClO(OH)3·H2O的摩尔质量为168.5g·mol-1,Mg2ClO(OH)3·H2O中镁含量的理论值:![]() =28.49%,产品中镁含量的测定值为29.01%,大于28.49%,比理论值偏高;由Mg2ClO(OH)3·H2O~ClO-~Cl2,Mg2ClO(OH)3·H2O中有效氯含量的理论值:
=28.49%,产品中镁含量的测定值为29.01%,大于28.49%,比理论值偏高;由Mg2ClO(OH)3·H2O~ClO-~Cl2,Mg2ClO(OH)3·H2O中有效氯含量的理论值:![]() =42.14%,产品中有效氯含量的测定值为40.28%,小于42.14%,比理论值偏低 Mg(OH)2等杂质;制备过程能减少产品中含有该杂质的措施:在形成沉淀的过程中加速搅拌、缓慢滴加NaOH溶液等(答出一点即可)
=42.14%,产品中有效氯含量的测定值为40.28%,小于42.14%,比理论值偏低 Mg(OH)2等杂质;制备过程能减少产品中含有该杂质的措施:在形成沉淀的过程中加速搅拌、缓慢滴加NaOH溶液等(答出一点即可)
【解析】
(1)从上述流程中可以看出,Mg2+、ClO-、OH-都进入沉淀中,则滤液中含有Na+、Cl-;
(2)Cl2与NaOH溶液反应获得NaCl、NaClO等;
(3)①Mg2ClO(OH)3·H2O的摩尔质量为168.5 g·mol-1,Mg2ClO(OH)3·H2O中镁含量的理论值:![]() =28.49%,根据实际镁含量与理论镁含量相比,确定偏高还是偏低,Mg2ClO(OH)3·H2O中有效氯含量的理论值:
=28.49%,根据实际镁含量与理论镁含量相比,确定偏高还是偏低,Mg2ClO(OH)3·H2O中有效氯含量的理论值:![]() =42.14%,根据实际有效氯含量与理论有效氯含量相比,确定偏高还是偏低。
=42.14%,根据实际有效氯含量与理论有效氯含量相比,确定偏高还是偏低。
②通过比较确定镁含量变化,推测产品中可能含有Mg(OH)2、MgCl2、Mg(ClO)2中的某一种或几种,并制订制备过程能减少杂质的措施。
(1)从上述流程中可以看出,Mg2+、ClO-、OH-都进入沉淀中,则滤液中含有Na+、Cl-,可回收的主要物质是NaCl;
(2)Cl2与NaOH溶液反应获得NaClO,反应的化学方程式为Cl2+2NaOH=NaCl+NaCl+H2O;
(3)①Mg2ClO(OH)3·H2O的摩尔质量为168.5g·mol-1,Mg2ClO(OH)3·H2O中镁含量的理论值:![]() =28.49%,产品中镁含量的测定值为29.01%,大于28.49%,比理论值偏高;由Mg2ClO(OH)3·H2O~ClO-~Cl2,Mg2ClO(OH)3·H2O中有效氯含量的理论值:
=28.49%,产品中镁含量的测定值为29.01%,大于28.49%,比理论值偏高;由Mg2ClO(OH)3·H2O~ClO-~Cl2,Mg2ClO(OH)3·H2O中有效氯含量的理论值:![]() =42.14%,产品中有效氯含量的测定值为40.28%,小于42.14%,比理论值偏低。
=42.14%,产品中有效氯含量的测定值为40.28%,小于42.14%,比理论值偏低。
②由于产品中有效氯含量偏低而镁含量偏高,据此推测产品中可能含有Mg(OH)2等杂质[只填MgCl2或Mg(ClO)2不对,因为Mg(OH)2中镁元素含量为41.38%;MgCl2中镁元素含量为25.26%;Mg(ClO)2中镁元素含量为18.90%,有效氯含量为111.8%];制备过程能减少产品中含有该杂质的措施:在形成沉淀的过程中加速搅拌、缓慢滴加NaOH溶液等(答出一点即可)。答案为:Mg(OH)2等杂质;在形成沉淀的过程中加速搅拌、缓慢滴加NaOH溶液等(答出一点即可)。

【题目】25℃时,电离常数:
化学式 | CH3COOH | H2CO3 | HCN |
电离常数 | 1.8×10-5 | K1:4.3×10-7 K2:5.6×10-11 | 4.9×10-10 |
请回答下列问题:
(1)物质的量浓度为0.1mol·L-1的下列四种物质:
a.Na2CO3 b.NaCN c.CH3COONa d.NaHCO3
pH由大到小的顺序是____(填标号)。
(2)25℃时,在0.5mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的__倍。
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:______。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=___(填准确数值)。c(CH3COO-)/c(CH3COOH)=____。
(5)25℃时,将amol·L-1的醋酸与bmol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为____。
(6)某温度时,纯水的pH=6。该温度下0.01mol/LNaOH溶液的pH=___,向该温度下的纯水中加入少量的碳酸钠固体,使溶液pH为9,则水电离出的c(OH-)=____。
【题目】工业上将苯的蒸气通过赤热的铁合成一种可作传热载体的化合物,该化合物分子中苯环上的一氯代物有3种,1mol该化合物催化加氢时最多消耗6mol氢气,判断这种化合物可能是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. 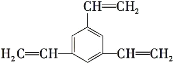
【题目】丙烯酸甲酯(CH2=CHCOOCH3)是一种重要的有机化工原料。实验室制备少量丙烯酸甲酯的反应为:CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O,步骤如下:
CH2=CHCOOCH3+H2O,步骤如下:
步骤1:在100mL圆底烧瓶中依次加入10.0g丙烯酸、少许碎瓷片、10mL甲醇和2mL浓硫酸,搅拌。
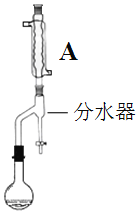
步骤2:如图,连接装置,加热烧瓶中的混合液,用锥形瓶盛接通过分水器分离出的水。当不再有水生成,停止加热。
步骤3:反应液冷却后,依次用5%Na2CO3溶液、饱和食盐水、水洗涤。分离出有机相。
步骤4;向有机相中加无水Na2SO4固体,过滤后蒸馏,收集70~90℃馏分。测得丙烯酸甲酯的质量为6.45g。
可能用到的信息:
密度 | 沸点 | 溶解性 | ||
丙烯酸 | 1.05g·cm-3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 0.79g·cm-3 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 0.95g·cm-3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
请回答下列问题:
(1)步骤1中,加入碎瓷片的目的是________。
(2)步骤2中,图中所示装置中仪器A的名称是______,其作用为_______。
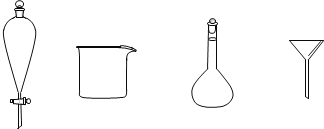
(3)步骤3中,用5%Na2CO3溶液洗涤后,分离有机相的操作名称为_______,分离有机相时不需要用到下列玻璃仪器中的_______(填名称)。
(4)实验中可能生成的有机副产物结构简式为_______ (填一种即可)。
(5)本实验中丙烯酸甲酯的产率为______%。